Tổng hợp Tính chất hóa học của đơn chất, hợp chất | Định nghĩa hóa học | Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng
Loạt bài tổng hợp định nghĩa, tính chất của tất cả các đơn chất, hợp chất trong Bảng hệ thống tuần hoàn đã học trong chương trình môn Hóa học cấp 2, cấp 3 gồm: tính chất hoá học, tính chất vật lí, cách nhận biết, điều chế và ứng dụng giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.

Mục lục Tổng hợp Tính chất hóa học của đơn chất, hợp chất
Tính chất đơn chất, hợp chất Kim loại
- Tính chất của Kim loại
- Tính chất của Kim loại kiềm
- Tính chất của Kim loại kiềm thổ
- Tính chất của Liti (Li)
- Tính chất của Natri (Na)
- Tính chất của Kali (K)
- Tính chất của Xesi (Cs)
- Tính chất của Beri (Be)
- Tính chất của Magie (Mg) và hợp chất của Magie
- Tính chất của Canxi (Ca) và hợp chất của Canxi
- Tính chất của Bari (Ba) và hợp chất của Bari
- Tính chất của Nhôm (Al) và hợp chất của Nhôm
- Tính chất của Crom (Cr) và hợp chất của Crom
- Tính chất của Mangan (Mn)
- Tính chất của Sắt (Fe) và hợp chất của Sắt
- Tính chất của Niken (Ni) và hợp chất của Ni
- Tính chất của Platin (Pt)
- Tính chất của Đồng (Cu) và hợp chất của Đồng
- Tính chất của Bạc (Ag) và hợp chất của Bạc
- Tính chất của Vàng (Au) và hợp chất của Vàng
- Tính chất của Kẽm (Zn) và hợp chất của Kẽm
- Tính chất của Chì (Pb) và hợp chất của Chì
- Tính chất của Thiếc (Sn)
Tính chất đơn chất, hợp chất Phi kim
- Tính chất của Phi kim
- Tính chất của Iot (I)
- Tính chất của Brom (Br)
- Tính chất của Cacbon (C)
- Tính chất của Flo (F)
- Tính chất của Lưu huỳnh (S)
- Tính chất của Nitơ (N)
- Tính chất của Photpho (P)
- Tính chất của Silic (Si)
- Tính chất của Oxi (O)
Tính chất hợp chất hữu cơ
- Tính chất của Ankan
- Tính chất của Anken
- Tính chất của Ankin
- Tính chất của Ankadien
- Tính chất của Benzen
- Tính chất của Naphtalen
- Tính chất của Stiren
- Tính chất của Phenol
- Tính chất của rượu Etylic (C2H5OH)
- Tính chất của Axit Axetic
- Tính chất của Xenlulozo
- Tính chất của Tinh bột
- Tính chất của Protein
- Tính chất của Saccarozo
- Tính chất của Glucozo
- Tính chất của Este
- Tính chất của Chất béo (Lipit)
- Tính chất các Amin quan trọng
- Tính chất của Amin
- Tính chất các Amino axit quan trọng
- Tính chất của Amino axit
- Tính chất của Protein
- Polietilen (C2H4)n
- Poli vinyl clorua (C2H3Cl)n
- Poli metyl metacrylat (C5H8O2)n
- Polibutađien (Cao su Buna) (C4H6)n
Tính chất của Kim loại
I. Tính chất vật lí
• Tính dẻo
- Kim loại có tính dẻo.
- Các kim loại khác nhau có tính dẻo khác nhau.Do có tính dẻo nên kim loại được rèn, kéo sợi, dát mỏng tạo nên các đồ vật khác nhau.
• Tính dẫn điện
- Kim loại có tính dẫn điện.
- Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại có khả năng dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,...Do có tính dẫn điện, một số kim loại được sử dụng làm dây dẫn điện. Thí dụ như: đồng, nhôm, ...
- Chú ý: Không nên sử dụng dây dẫn điện trần hoặc dây điện đã bị hỏng lớp bọc cách điện để tránh bị điện giật, hay cháy do chập điện,...
• Tính dẫn nhiệt
- Kim loại có tính dẫn nhiệt .
- Kim loại khác nhau có tính dẫn nhiệt khác nhau. Kim loại nào dẫn điện tốt cũng thường dẫn nhiệt tốt.
- Dó có tính dẫn nhiệt và một số tính chất khác, nhôm, thép không gỉ (inox) được dùng để làm dụng cụ nấu ăn.
• Ánh kim
- Kim loại có ánh kim.Nhờ tính chất này, một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
II. Tính chất hóa học
• Phản ứng của kim loại với phi kim
1 Tác dụng với oxi
- Khi đốt nóng đỏ, sắt cháy trong oxi tạo thành oxit sắt từ
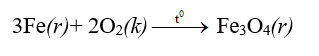
- Nhiều phi kim khác như Al, Zn, Cu... phản ứng với oxi tạo thành các oxit Al2O3, ZnO, CuO...
2 Tác dụng với phi kim khác
- Natri nóng chảy cháy trong khí clo tạo thành khói trắng.
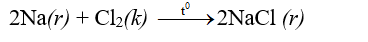
- Ở nhiệt độ cao, đồng, magie, sắt... phản ứng với lưu huỳnh cho sản phẩm là các muối sunfua CuS, MgS, FeS,...
- Hầu hết kim loại (trừ Ag, Au, Pt...) phản ứng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit (thường là oxit bazơ). Ở nhiệt độ cao kim loại phản ứng với nhiều phi kim khác tạo thành muối.
• Phản ứng của kim loại với dung dịch axit
- Một số kim loại phản ứng với dung dịch axit (H2SO4 loãng, HCl...) tạo thành muối và giải phóng khí hiđro.
Zn(r)+H2SO4(dd)→ZnSO4 (dd)+ H2(k)
• Phản ứng của kim loại với dung dịch muối
- Phản ứng của đồng với dung dịch bạc nitrat
Cu (r)+ 2AgNO3 (dd)→ Cu(NO3)2 (dd) + 2Ag (r)
Đồng đã đẩy bạc ra khỏi muối. Ta nói đồng hoạt động hóa học mạnh hơn bạc.
- Phản ứng của kẽm với dung dịch đồng (II) sunfat
Kẽm đẩy đồng ra khỏi dung dịch CuSO4.
Zn (r) + CuSO4 (dd) → ZnSO4 (dd) + Cu (r)
Ta nói kẽm hoạt động hóa học mạnh hơn đồng.
- Phản ứng của kim loại Mg, Al, Zn, ... với dung dịch CuSO4 hay AgNO3 tạo thành muối magie, muối nhôm, muối kẽm, ... và kim loại Cu và Ag được giải phóng.
Ta nói: Al, Zn, Mg hoạt động hóa học mạnh hơn Cu, Ag.
=>Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Ca ...) có thể đẩy kim loại hoạt động hóa học yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.

III. Điều chế
Nguyên tắc điều chế kim loại
- Trong tự nhiên chỉ có một số ít kim loại ở trạng thái tự do, hầu hết các kim loại đều tồn tại dưới dạng ion trong các hợp chất hóa họ. Muốn chuyển hóa những ion này thành kim loại ta thực hiện quá trình khử ion kim loại:
Mn+ + ne → M
- Có 3 phương pháp điều chế kim loại.
1) Phương pháp thủy luyện
- Phương pháp thủy luyện (còn gọi là phương pháp ướt) được dùng điều chế những kim loại có tính khử yếu, như Cu, Hg, Ag, Au,...
2) Phương pháp nhiệt luyện
- Phương pháp nhiệt luyện được ứng dụng rộng rãi trong công nghiệp dùng để điều chế những kim loại có độ hoạt động hóa học trung bình như Zn, Fe, Sn, Pb,...
- Với những kim loại kém hoạt động như Hg, Ag chỉ cần đốt cháy quặng cũng đã thu được kim loại mà không cần thiết phải khử bằng các tác nhân khác:
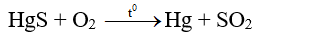
3) Phương pháp điện phân
- Điều chế kim loại có tính khử mạnh như Li, Na, K, Al, ... bằng cách điện phân các hợp chất ( muối, bazơ, oxit) nóng chảy của chúng.
- Thí dụ: Điều chế kim loại kẽm bằng phương pháp điện phân dung dịch kẽm sunfat với điện cực trơ.
Phương trình điện phân:
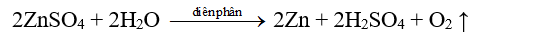
Tính chất của Kim loại kiềm
I. Vị trí và cấu tạo
1. Vị trí của kim loại kiềm trong bảng tuần hoàn
- Sáu nguyên tố hóa học đứng sau nguyên tố khí hiếm là liti (Li), natri (Na), kali (K), rubiđi (Rb), xesi (Cs), franxi (Fr) được gọi là các kim loại kiềm.
- Các kim loại kiềm thuộc nhóm IA, đứng ở đầu mỗi chu kì (trừ chu kì I).
2. Cấu tạo và tính chất của kim loại kiềm
- Cấu hình electron: Kim loại kiềm là những nguyên tố s. Lớp e ngoài cùng của nguyên tử chỉ có 1e, ở phân lớp ns1 (n là số thứ tự chu kì). So với những electron khác trong nguyên tử thì electron ns1 ở xa hạt nhân nguyên tử nhất, do đó dễ tách khỏi nguyên tử. Các cation M+ của kim loại kiềm có cấu hình electron của nguyên tử khí hiếm đứng trước.
- Năng lượng ion hóa: Các nguyên tử kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất so với các kim loại khác cùng chu kì. Do vậy các kim loại kiềm có tính khử rất mạnh:
M → M+ + e
- Năng lượng ion hóa I2 của các nguyên tử kim loại kiềm lớn hơn năng lượng ion hóa I1 nhiều lần (từ 6 đến 14 lần). Vì vậy, trong các phản ứng hóa học nguyến tử kim loại kiềm chỉ nhường 1 electron.
- Trong nhóm kim loại kiềm, năng lượng ion hóa I1 giảm dần từ Li đến Cs.
- Số oxi hóa: Trong các hợp chất, nguyên tố kim loại kiềm chỉ có số oxi hóa +1.
- Thế điện cực chuẩn: Thế điện cực chuẩn của kim loại kiềm rất âm.
II. Tính chất vật lí
Các kim loại kiềm có cấu tạo mạng tinh thể lập phương tâm khối là kiểu mạng kém đặc khít.
1. Nhiệt độ nóng chảy và nhiệt độ sôi
- Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại kiềm thấp hơn nhiều so với các kim loại khác. Tính chất này là do liên kết kim loại trong mạng tinh thể kim loại kém bền vững.
2. Khối lượng riêng
- Khối lượng riêng của các kim loại kiềm cũng nhỏ hơn so với các kim loại khác. Khối lượng riêng của các kim loại nhỏ là do nguyên tử của các kim loại kiềm có bán kính lớn và do có cấu tạo mạng tinh thể của chúng kém đặc khít.
3. Tính cứng
- Các kim loại kiềm đều mềm, chúng có thể cắt bằng dao. Tính chất này là do liên kết kim loại trong mạng tinh thể yếu.
III. Tính chất hóa học
Các nguyên tử kim loại kiềm đều có năng lượng ion hóa I1 thấp và thế điện cực chuẩn E0 có giá trị rất âm. Vì vậy kim loại kiềm có tính khử rất mạnh.
1. Tác dụng với phi kim
- Hầu hết các kim loại kiềm có thể khử được các phi kim.
- Thí dụ: kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hóa -1:
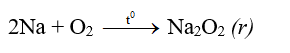
2. Tác dụng với axit
- Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm):
2Li + 2HCl → 2LiCl + H2↑
- Dạng tổng quát:
2M + 2H+ → 2M+ + H2↑
3. Tác dụng với nước
- Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro:
2Na + 2H2O → 2NaOH (dd) + H2↑
- Dạng tổng quát:
2M + 2H2O → 2MOH (dd) + H2↑
- Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa.
IV. Điều chế
- Kim loại kiềm dễ bị oxi hóa thành ion dương, do vậy trong tự nhiên kim loại kiềm chỉ tồn tại ở dạng hợp chất.
- Điều chế kim loại kiềm bằng cách khử ion của chúng:
M+ + e → M
- Tuy nhiên, không có chất nào khử được ion kim loại kiềm.
- Phương pháp thường dùng để điều chế kim loại kiềm là điện phân nóng chảy muối halogenua của kim loại kiềm.
- Thí dụ: Điện phân muối NaCl
Phương trình điện phân:
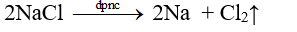
V. Ứng dụng
- Kim loại kiềm có nhiều ứng dụng quan trọng.
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiếp bị báo cháy,...
- Các kim loại kali, natri dùng làm chất trao đổi nhiệt trong một vài lò phản ứng hạt nhân.
- Kim loại xesi dùng chế tạo tế bào quang điện.
- Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
- Kim loại kiềm được dùng nhiều trong tổng hợp hữu cơ.
Tính chất của Kim loại kiềm thổ
I. Vị trí và cấu tạo
1. Vị trí của kim loại kiềm thổ trong bảng tuần hoàn
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn, gồm các nguyên tố beri (Be), magie (Mg), canxi (Ca), stronti (Sr), bari (Ba) và rađi (Ra). Trong mỗi chu kì, nguyên tố kim loại kiềm thổ đứng sau nguyên tố kim loại kiềm.
2. Cấu tạo và tính chất của kim loại kiềm thổ
- Cấu hình electron: Kim loại kiềm thổ là những nguyên tố s. Lớp ngoài cùng của nguyên tử có 2e ở phân lớp ns2. So với những electron khác trong nguyên tử thì hai eletron ns2 ở xa hạt nhân hơn cả, chúng dễ tách khỏi nguyên tử.
- Các cation M2+ của kim loại kiềm thổ có cấu hình electron của nguyên tử khí hiếm đứng trước nó trong bảng tuần hoàn.
- Số oxi hóa: Các kim loại kiềm thổ có điện tích duy nhất là 2+. Vì vậy, trong các hợp chất, nguyên tố kim loại kiềm thổ có số oxi hóa là +2.
- Thế điện cực chuẩn: Các cặp oxi hóa – khử M2+/M của kim loại kiềm thổ đều có thế điện cực chuẩn rất âm.
II. Tính chất vật lí
- Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp (trừ beri )
- Độ cứng tuy có cao hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp.
- Khối lượng riêng tương đối nhỏ, chúng là những kim loại nhẹ hơn nhôm (trừ bari ).
III. Tính chất hóa học
- Các kim loại kiềm thổ đều có tính khử mạnh, nhưng yếu hơn so với kim loại kiềm. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
1. Tác dụng với phi kim
- Khi đối nóng, các kim loại kiềm thổ đều bốc cháy trong không khí tạo ra oxit.
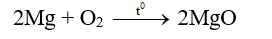
- Tác dụng với halogen tạo muối halogen.
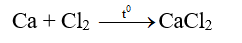
2. Tác dụng với axit
- Các kim loại kiềm thổ đều khử được H+ trong các dung dịch axit (H2SO4 loãng, HCl) thành khí hiđro.
Ca + HCl → CaCl2 + H2↑
3. Tác dụng với nước
- Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo thành dung dịch bazơ. Mg tác dụng chậm với nước ở nhiệt độ thường tạo ra Mg(OH)2, tác dụng nhanh với hơi nước ở nhiệt độ cao tạo thành MgO. Be không tác dụng với nước dù ở nhiệt độ cao.
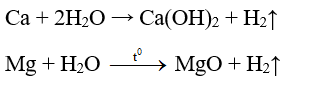
IV. Điều chế
- Trong tự nhiên, kim loại kiềm thổ chỉ tồn tại dưới dạng ion M2+ trong các hợp chất. Phương pháp cơ bản điều chế kim loại kiềm thổ là điện phân muối nóng chảy của chúng.
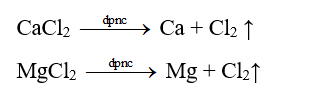
V. Ứng dụng
- Kim loại Be được dùng làm chất phụ gia để chế tạo những hợp kim có tính đàn hồi cao, bền chắc, không bị ăn mòn.
- Kim loại Mg có nhiều ứng dụng hơn cả, được dùng để chế tạo những hợp kim có đặc tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô ,... Kim loại Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm.
- Kim loại Ca dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép. Canxi còn được dùng để làm khô một số hợp chất hữu cơ.

