Tính chất các Amin quan trọng - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất các Amin quan trọng - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Với Tính chất các Amin quan trọng được tổng hợp đầy đủ tất cả các tính chất hoá học, tính chất vật lí, cách nhận biết, điều chế và ứng dụng giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.

Tính chất các Amin quan trọng
- Tính chất của Metylamin CH5N
- Tính chất của Etylamin C2H7N
- Tính chất của Propylamin C3H9N
- Tính chất của Isopropylamin C3H9N
- Tính chất của Butylamin C4H11N
- Tính chất của Đimetylamin C2H7N
- Tính chất của Đietylamin C4H11N
- Tính chất của Anilin C6H7N
I. Định nghĩa
- Định nghĩa: Amin là sản phẩm thu được khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon.
- Công thức tổng quát: CxHyNz hoặc CnH2n+2-2k+tNt
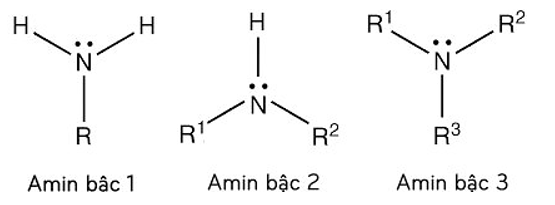
Tên gọi:
+ Tên thay thế: Tên hiđrocacbon + vị trí + amin
Ví dụ: CH3NH2 (Metanamin)
+ Tên gốc chức: Tên gốc hiđrocacbon + amin
Ví dụ: CH3NH2 (Metylamin)
+ Tên thường
II. Tính chất vật lí và nhận biết
- Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, nhiệt độ sôi là 184°C, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
III. Tính chất hóa học
1. Tính Bazơ :
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1NH2 > HNH2 > C6H5NH2
2. Phản ứng với axit nitrơ HNO2 :
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5°C) cho muối điazoni:
C6H5NH2 + HONO + HCl → C6H5N2+Cl- + 2H2O

3. Phản ứng ankyl hóa :
- Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …) , nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
- Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
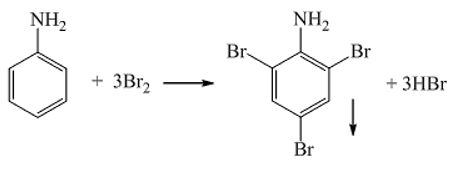
4. Phản ứng thế ở nhân thơm của anilin :
IV. Điều chế
- Thay thế nguyên tử H của phân tử amoniac:
NH3 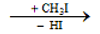
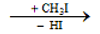
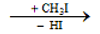
- Khử hợp chất nitro:
C6H5NO2 +6H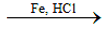 C6H5NH2 + 2H2O
C6H5NH2 + 2H2O
V. Ứng dụng
- Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
- Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,...), polime (nhựa anilin - fomanđehit,...), dược phẩm (streptoxit, suafaguaniđin,...)

