Tính chất của Iot (I) - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất của Iot (I) - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Với Tính chất của Iot (I) được tổng hợp đầy đủ tất cả các tính chất hoá học, tính chất vật lí, cách nhận biết, điều chế và ứng dụng giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.

I. Định nghĩa
- Iot là một phi kim hay còn được gọi là một halogen
- Kí hiệu: I
- Cấu hình electron:[Kr]4d105s25p5
- Số hiệu nguyên tử: Z = 53
- Khối lượng nguyên tử: 127
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 53, nhóm VIIA
+ Chu kì: 5
- Độ âm điện: 2,66
II. Tính chất vật lí & nhận biết
- Ở điều kiện bình thường, iot là chất rắn, dạng tinh thể, có màu đen tím.
- Khi đun nóng, iot thăng hoa: I2 (tt)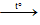
- Iot tan ít trong nước, tan nhiều trong dung môi hữu cơ: etanol, ete,…
- Iot tạo thành với hồ tinh bột hợp chất có màu xanh → dùng hồ tinh bột để nhận biết iot.
III. Tính chất hóa học
Nhận xét: Iot là một chất có tính oxi hóa nhưng kém brom
1. Tác dụng với kim loại
Iot oxi hóa được nhiều kim loại trong điều kiện đun nóng hoặc có chất xúc tác
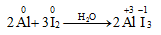
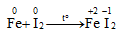
Không xảy ra phản ứng: FeI2 + I2 →
2. Tác dụng với hiđro
Iot chỉ oxi hóa được hiđro ở nhiệt độ cao, có chất xúc tác, phản ứng thuận nghịch và thu nhiệt
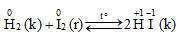

3. Tác dụng với nước và với dung dịch kiềm
* Khi tác dụng với nước:
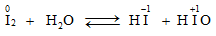
* Khi tác dụng với kiềm:
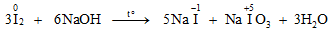
Chú ý: Trong các phản ứng trên, clo vừa là chất oxi hóa, vừa là chất khử.
4. Tác dụng với Cl2/H2O
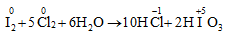
IV. Trạng thái tự nhiên
Iot chỉ tồn tại ở dạng hợp chất, hợp chất của iot tồn tại trong nước biển, rong biển nhưng ít hơn so với các halogen khác.
V. Điều chế
* Điều chế iot đi từ rong biển, việc điều chế iot dựa vào sự oxi hóa ion I-
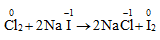
VI. Ứng dụng
- Muối iot: NaCl + (KI + KIO3) → phòng, chữa bệnh bướu cổ
- Chất sát trùng: cồn iot 5%
- Điều chế dược phẩm
VII. Các hợp chất quan trọng của clo
- Khí hiđro iotua, axit iothiđric (HI)
- Muối iotua (I- )

