Tính chất của Benzen - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất của Benzen - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Với Tính chất của Benzen được tổng hợp đầy đủ tất cả các tính chất hoá học, tính chất vật lí, cách nhận biết, điều chế và ứng dụng giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.

I. Định nghĩa
- Định nghĩa:
Benzen là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước, hòa tan nhiều chất như: dầu ăn, nến, cao su, iot....Benzen có mùi thơm nhẹ nhưng có hại cho sức khỏe.
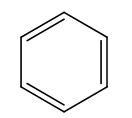
- Công thức phân tử: C6H6.
- Công thức cấu tạo:
II. Tính chất vật lí và nhận biết
- Benzen là chất lỏng, không màu, không tan trong nước, nhẹ hơn nước, hòa tan nhiều chất như: dầu ăn, nến, cao su, iot....Benzen độc.
III. Tính chất hóa học
1. Phản ứng thế
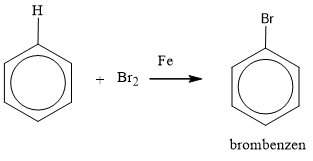
a) Phản ứng halogen hóa
• Khi có bột sắt, benzen tác dụng với brom khan tạo thành brombenzen và khí hiđro bromua.
• Nếu không dùng sắt mà chiếu sáng (as) thì Brom thế cho hiđro ở nhánh.
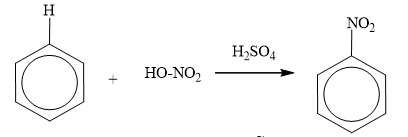
b) Phản ứng nitro hóa
Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen:
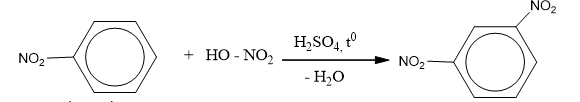
Nitro benzen tác dụng với hỗn hợp axit HNO3 bốc khói và H2SO4 đậm đặc đồng thời đun nóng thì tạo thành m-đinitrobenzen.
c) Quy tắc thế ở vòng benzen
Khi vòng benzen đã có sắn nhóm ankyl (hay các nhóm –OH, -NH2, -OCH3,...
Phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí nhóm ortho và para. Ngược lại, nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, -SO3H, ...) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.

d) Cơ chế phản ứng thế ở vòng benzen
Phân tử halogen hoặc phân tử axit nitric không trực tiếp tấn công. Các tiểu phân mag điện tích dương tạo thành do tác dụng của chúng với xúc tác mới là tác nhân tấn công trực tiếp vào vòng benzen. Thí dụ:
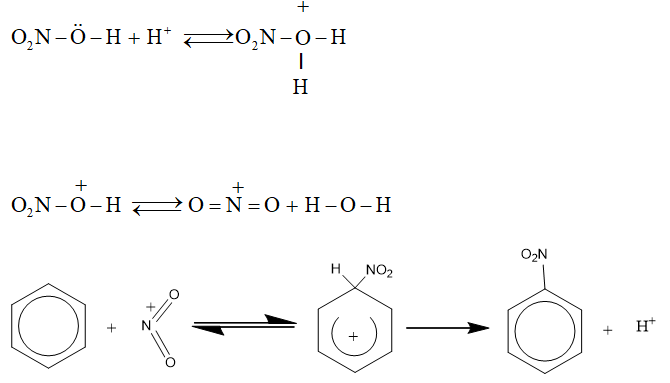
2. Phản ứng cộng
- Benzen không tác dụng được với brom trong dung dịch, chứng tỏ benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp, benzen có phản ứng cộng với một số chất:
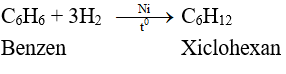
Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế vừa có phản ứng cộng. Tuy nhiên phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
3. Phản ứng oxi hóa
• Benzen không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4).
• Cũng như các hiđrocacbon khác, benzen cháy dễ tạo ra khí cacbon đioxit và hơi nước.
C6H6 + O2 → 6CO2 + 3H2O
Tuy nhiên, khi benzen cháy trong không khí, ngoài cacbon đioxit và hơi nước còn sinh ra muội than.
Benzen tương đối dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền vững các chất oxi hóa. Đây cũng là tính chất hóa học đặc trưng của hiđrocacbon thơm nên được gọi là tính thơm.
IV. Điều chế
- Benzen thường được tách bằng cách chưng cất dầu mỏ và nhựa than đá. Chúng còn được điều chế từ ankan hoặc xicloankan
CH3[CH2]4CH3 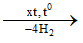
V. Ứng dụng
- Benzen là nguyên liệu quan trọng nhất của công nghiệp hóa hữu cơ.
- Benzen được dùng nhiều chất để tổng hợp các monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi (chẳng hạn poli stiren, cao su buna – stiren, tơ capron). Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol để dùng tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại,...
- Benzen được sử dụng làm dung môi trong công nghiệp và trong phòng thí nghiệm.

