Tính chất của Nitơ (N) - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất của Nitơ (N) - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Với Tính chất của Nitơ (N) được tổng hợp đầy đủ tất cả các tính chất hoá học, tính chất vật lí, cách nhận biết, điều chế và ứng dụng giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.

I. Định nghĩa
- Nitơ là một phi kim
- Kí hiệu: N → CTPT: N2
- Cấu hình electron: 1s22s22p3
- Số hiệu nguyên tử: Z = 7
- Khối lượng nguyên tử: 14
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 7, nhóm VA
+ Chu kì: 2
- Đồng vị: nitơ có 2 đồng vị bền là 147N và 157N
- Độ âm điện: 3,04
II. Tính chất vật lí & nhận biết
- Ở điều kiện bình thường, nitơ là chất khí không màu, không mùi, không vị, chiếm khoảng 80% V không khí.
- Nitơ tan rất ít trong nước (đơn giản coi không tan trong nước).
- Khí nitơ không duy trì sự sống và sự cháy.
- Nhiệt độ sôi: -196oC

III. Tính chất hóa học
Nhận xét:
- Ở điều kiện thường, nitơ kém hoạt động hóa học vì có liên kết ba bền. Ở nhiệt độ cao, liên kết ba đẽ đứt hơn nên nitơ hd hóa học hơn.
- Nitơ vừa có tính oxi hóa, vừa có tính khử
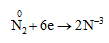
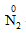
1. Tính oxi hóa
a. Tác dụng với hiđro
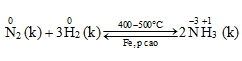
b. Tác dụng với kim loại hoạt động
- Nitơ oxi hóa liti (Li) ở nhiệt độ thường: 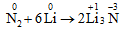
- Nitơ chỉ oxi hóa các kim loại hoạt động khi đốt nóng:
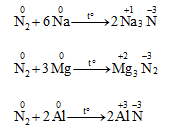
2. Tính khử
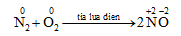
IV. Điều chế
1. Trong phòng thí nghiệm
NH4NO2 (dung dịch bão hòa) 
Có thể thay: Đun nóng dung dịch bão hòa của NH4Cl + NaNO2
NH4Cl + NaNO2 
2. Trong công nghiệp
* Phương pháp: chưng cất phân đoạn không khí lỏng
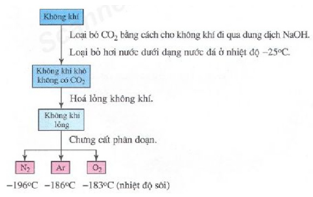
V. Ứng dụng
- Sản xuất khí amoniac ( NH3)
- Dùng nitơ lỏng để bảo quản máu, xác,…
- Dùng khí nitơ để bảo quản thực phẩm, chữa bệnh,…
VI. Các hợp chất quan trọng của nitơ
- Amoniac (NH3 ), muối amoni
- Các oxit của nitơ
- Axit nitric (HNO3 ), muối nitrat (NO3- )

