Tính chất của Etylamin C2H7N - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất của Etylamin C2H7N
I. Định nghĩa
- Định nghĩa: Etylamin là một hợp chất hữu cơ thuộc chức amin được tạo ra khi thế một nguyên tử hiđro trong phân tử amoniac bằng một gốc etyl
- Công thức phân tử: C2H7N
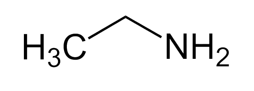
- Công thức cấu tạo: CH3CH2NH2
- Tên gọi
+ Tên gốc chức: Etylamin
+ Tên thay thế: Etanamin
II. Tính chất vật lí và nhận biết
- Etylamin là chất khí có mùi khai khó chịu, độc, tan tốt trong nước
III. Tính chất hóa học
1. Tính bazơ :
- Dung dịch Etylamin có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac
- Amin có tính bazo yếu nên có thể phản ứng với các axit vô cơ để tạo thành muối
2. Phản ứng với axit nitrơ :
C2H5-NH2 + HONO → C2H5-OH + N2 + H2O (xúc tác HCl)
3. Phản ứng ankyl hóa :
C2H5NH2 + CH3I → C2H5-NH-CH3 + HI
4. Phản ứng với dung dịch muối của các kim loại có hiđroxit kết tủa :
3C2H5NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3C2H5NH3Cl
IV. Điều chế
- Etylamin có thể được điều chế trong phòng thí nghiệm bằng phản ứng của etylen với amoniac với sự hiện diện của chất xúc tác là amit kim loại kiềm như amit natri
H2C=CH2 + NH3 → CH3CH2NH2
- Nó cũng có thể tổng hợp từ etanal và clorua amoni
2CH3CHO + NH4Cl → CH3CH2NH3Cl + CH3COOH
CH3CH2NH3Cl + NaOH → CH3CH2NH2 + NaCl + H2O

V. Ứng dụng
- Etylamin được sử dụng rộng rãi trong công nghiệp hóa chất và tổng hợp hữu cơ
- Etylamin, giống như một vài amin khác, có tính chất bất thường là hòa tan liti kim loại để tạo ra ion [Li(amin)4]+ và electron sonvat hóa. Làm bay hơi dung dịch này sẽ thu lại được liti kim loại. Các dung dịch như thế được sử dụng trong khử các hợp chất hữu cơ chưa no, như naphtalen

