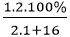Bài tập lý thuyết về hidro, nước lớp 8 cực hay
Bài tập lý thuyết về hidro, nước lớp 8 cực hay
Haylamdo biên soạn và sưu tầm Bài tập lý thuyết về hidro, nước lớp 8 cực hay môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
Một số lý thuyết cần nắm vững để làm được các bài tập lý thuyết về hiđro và nước:
I. Hiđro
1. Tính chất vật lí:
Khí hiđro là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước.
2. Tính chất hóa học:
Khí hiđro có tính khử, ở nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi mà còn có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. Các phản ứng này đều tỏa nhiều nhiệt.
a) Tác dụng với oxi
Hiđro cháy trong oxi cho ngọn lửa màu xanh và tạo thành nước
Phương trình hóa học: 2H2 + O2 
b) Tác dụng với một số oxit kim loại
- Hiđro có tính khử, khử một số oxit kim loại ở nhiệt độ cao.
Phương trình hóa học: H2 + CuO 
3. Ứng dụng
- Làm nguyên liệu cho động cơ tên lửa, nhiên liệu cho động cơ ô tô thay cho xăng
- Làm nguyên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ
- Dùng để điều chế kim loại từ oxit của chúng
- Bơm vào khinh khí cầu, bóng thám không vì là khí nhẹ nhất.
4. Điều chế
a) Trong phòng thí nghiệm
Nguyên tắc: cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm).
Ví dụ: H2SO4 + Zn → ZnSO4 + H2↑
b) Trong công nghiệp
- Điện phân nước: 2H2O điện phân→ 2H2↑ + O2↑
- Hoặc dùng than khử oxi của nước trong lò khí than hoặc sản xuất H2 từ khí thiên nhiên, khí dầu mỏ.
II. Nước
1. Thành phần hóa học của nước
a) Sự phân hủy nước: Khi có dòng điện một chiều chạy qua, nước bị phân huỷ thành khí hiđro và oxi
Phương trình hóa học: 2H2O điện phân→ 2H2↑ + O2↑
b) Sự tổng hợp nước
Phương trình hóa học: 2H2 + O2 
c) Kết luận
Nước là hợp chất tạo bởi 2 nguyên tố là hiđro và oxi.
- Tỉ lệ thể tích: 2 phần khí khí H2 và 1 phần khí O2.
- Tỉ lệ khối lượng: 1 phần hiđro và 8 phần oxi.
2. Tính chất vật lý
- Nước là chất lỏng, không màu, không mùi, không vị, sôi ở 100ºC (dưới áp suất khí quyển là 760mmHg), hóa rắn ở 0ºC.
- Hoà tan nhiều chất: rắn (như muối ăn, đường…), lỏng (như cồn, axit …), khí (như amoniac, hiđro clorua…).
3. Tính chất hóa học
Nước tác dụng với một số kim loại ở nhiệt độ thường, tác dụng với một số bazơ và tác dụng với nhiều oxit axit.
a) Tác dụng với kim loại
Nước có thể tác dụng với một số kim loại như K, Na, Ca, Ba… ở nhiệt độ thường tạo ra bazơ tương ứng và khí hiđro.
Ví dụ: 2Na + 2H2O → 2NaOH + H2↑
b) Tác dụng với oxit bazơ
Nước có thể tác dụng với một số oxit bazơ như K2O, Na2O, CaO, BaO … tạo ra bazơ.
Ví dụ: CaO + H2O → Ca(OH)2
c) Tác dụng với oxit axit
Nước tác dụng với oxit axit tạo ra axit.
Ví dụ: P2O5 + 3H2O → 2H3PO4
3. Vai trò của nước và cách chống ô nhiễm nguồn nước:
a) Vai trò của nước
+ Hòa tan chất dinh dưỡng cần thiết cho cơ thể sống
+ Tham gia vào nhiều quá trình hóa học quan trọng trong cơ thể người và động vật
+ Có vai trò rất quan trọng trong đời sống hàng ngày, sản xuất công nghiệp, nông nghiệp, giao thông vân tải,…
b) Cách chống ô nhiễm nguồn nước
+ Không vứt rác thải xuống nguồn nước.
+ Xử lý nước thải trước khi cho nước thải chảy vào sông, hồ, biển.
+ Tuyên truyền nâng cao ý thức bảo vệ nguồn nước…
B. Ví dụ minh họa
Ví dụ 1: Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào? Giải thích ? Đối với khí hiđro, có làm như thế được không? Vì sao?
Lời giải
- Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì khí oxi nặng hơn không khí (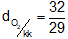
- Đối với khí hiđro không làm như thế được vì khí hiđro rất nhẹ so với không khí nên phải đặt ống nghiệm thẳng đứng và miệng ống nghiệm hướng xuống dưới.
Ví dụ 2: Những phản ứng hóa học nào dưới đây thường dùng để điều chế hiđro trong phòng thí nghiệm?
a. Zn + H2SO4 → ZnSO4 + H2↑
b. 2H2O 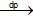
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Lời giải
Vì trong phòng thí nghiệm, khí hiđro thường được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại như Zn, Fe, Al.
→ Những phản ứng hóa học thường dùng để điều chế hiđro trong phòng thí nghiệm là:
a. Zn + H2SO4 → ZnSO4 + H2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Ví dụ 3: Tính thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra được 1,8 gam nước.
Lời giải
Số mol nước tạo thành là: nH2O = 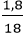
Phương trình hóa học:
2H2 + O2 
0,1 0,05 ← 0,1 (mol)
Thể tích khí hiđro tham gia phản ứng: VH2 = 22,4.nH2 = 22,4.0,1 = 2,24 lít
Thể tích khí oxi tham gia phản ứng: VO2 = 22,4.nO2 = 22,4.0,05 = 1,12 lít
C. Bài tập vận dụng
Câu 1: Tính chất nào sau đây không có ở khí hiđro:
A. Nặng hơn không khí
B. Nhẹ nhất trong các chất khí
C. Không màu
D. Tan rất ít trong nước
Đáp án A
Khí hiđro nhẹ hơn không khí: MH2 = 2 g/mol ; Mkk = 29 g/mol.
Câu 2: Khí nào nhẹ nhất trong các khí sau?
A. H2
B. H2O
C. O2
D. CO2
Đáp án A
Khí hiđro là khí nhẹ nhất trong các chất khí.
Câu 3: Ở điều kiện thường, hiđro là chất ở trạng thái nào?
A. Rắn.
B. Lỏng.
C. Khí.
D. Hợp chất rắn.
Đáp án C
Ở điều kiện thường, hiđro là chất ở trạng thái khí.
Câu 4: Ứng dụng của hiđro là:
A. Oxi hóa kim loại
B. Làm nguyên liệu sản xuất NH3, HCl, chất hữu cơ
C. Tạo hiệu ứng nhà kính
D. Tạo mưa axit
Đáp án B
Hiđro được dùng làm nguyên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ
Câu 5: Sau phản ứng của CuO với H2 thì có hiện tượng gì?
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Đáp án B
Phương trình hóa học: H2 + CuO 
Chất rắn ban đầu là CuO có màu đen, sau phản ứng chuyển thành Cu có màu đỏ
Câu 6: Nước được cấu tạo từ các nguyên tố hóa học nào?
A. Từ 1 nguyên tử hiđro và 1 nguyên tử oxi
B. Từ 2 nguyên tử hiđro và 1 nguyên tử oxi
C. Từ 1 nguyên tử hiđro và 2 nguyên tử oxi
D. Từ 2 nguyên tử hiđro và 2 nguyên tử oxi
Đáp án B
Công thức hóa học của nước là: H2O
→ Nước được cấu tạo từ 2 nguyên tử hiđro và 1 nguyên tử oxi
Câu 7: Kết luận nào sau đây đúng?
A. Tất cả kim loại tác dụng với nước đều tạo ra bazơ tương ứng và khí hiđro.
B. Nước là chất lỏng không màu, không mùi, không vị.
C. Nước làm đổi màu quỳ tím.
D. Na tác dụng với H2O sinh ra khí O2.
Đáp án B
A sai vì không phải tất cả kim loại đều tác dụng với nước.
C sai, nước không làm đổi màu quỳ tím.
D sai vì Na tác dụng với H2O sinh ra khí H2.
Câu 8: Hiđro và oxi đã hóa hợp theo tỉ lệ nào về thể tích để tạo thành nước?
A. 2 phần khí H2 và 1 phần khí O2
B. 3 phần khí H2 và 1 phần khí O2
C. 1 phần khí H2 và 2 phần khí O2
D. 1 phần khí H2 và 3 phần khí O2
Đáp án A
Phương trình hóa học: 2H2 + O2 
Hiđro và oxi đã hóa hợp theo tỉ lệ 2 phần khí H2 và 1 phần khí O2 về thể tích để tạo thành nước
Câu 9: Dãy gồm các kim loại tác dụng với nước ở nhiệt độ thường là:
A. Fe, Mg, Al.
B. Fe, Cu, Ag.
C. Zn, Al, Ag.
D. Na, K, Ca.
Đáp án D
Các kim loại như Na, K, Ca... tác dụng với nước ở nhiệt độ thường
Câu 10: Trong phân tử nước có phần trăm khối lượng nguyên tố H là:
A. 11,10%
B. 88,97%
C. 90,00%
D. 10,00%
Đáp án A
Phần trăm khối lượng nguyên tố H là:
%mH =