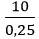Cách giải bài tập kim loại tác dụng với nước cực hay, chi tiết
Cách giải bài tập kim loại tác dụng với nước cực hay, chi tiết
Haylamdo biên soạn và sưu tầm Cách giải bài tập kim loại tác dụng với nước cực hay, chi tiết môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
Một số kim loại như: Na, K, Ba, Ca, Li, Sr … tác dụng với H2O tạo thành dung dịch kiềm và giải phóng khí H2
Ví dụ:
2Na + 2H2O → 2NaOH + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Các bước giải toán:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Tương tự như natri, các kim loại kali (K) và canxi (Ca) cũng tác dụng được với nước tạo thành bazơ tan và giải phóng hiđro.
a) Hãy viết phương trình phản ứng hóa học xảy ra.
b) Các phản ứng hóa học trên thuộc loại phản ứng hóa học nào?
Lời giải
a) Các Phương trình hóa học:
2K + 2H2O → 2KOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
b) Phản ứng hóa học trên thuộc loại phản ứng thế.
Ví dụ 2: Cho một hỗn hợp chứa 4,6g natri và 3,9g kali tác dụng hết với một lượng nước dư.
a) Viết phương trình phản ứng.
b) Tính thể tích khí hiđro thu được (đktc)
Lời giải
a) Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2↑ (1)
2K + 2H2O → 2KOH + H2↑ (2)
b) nNa = 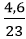
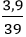
Theo phương trình: nH2 (1) = 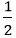
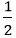
Vậy VH2 = 22,4.nH2 = 22,4.( 0,1 + 0,05 ) = 3,36 lít
Ví dụ 3: Cho 3,9 gam Kali tác dụng với 101,8 gam nước. Tính C% của dung dịch thu được?
Lời giải
Phương trình hóa học:
2K + 2H2O → 2KOH + H2↑
Ta có: nKOH = nK = 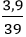
⇒ mKOH = 0,1.56 = 5,6 g
nH2 = 0,5.nK = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có:
mdd sau p/ư = mK + mH2O − mH2 = 3,9+ 101,8 – 0,05.2 = 105,6gam.
⇒ C%KOH = 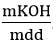
C. Bài tập vận dụng
Câu 1: Kim loại không tác dụng với nước ở nhiệt độ thường là:
A. Na
B. Ca
C. Ba
D. Fe
Đáp án D
Fe không tác dụng với nước ở nhiệt độ thường
Câu 2: Cho kim loại A, hóa trị II tác dụng với nước ở nhiệt độ thường. Biết rằng sau phản ứng thu được 3,36 lít khí thoát ra ở đktc và khối lượng của bazơ có trong dung dịch là 11,1 gam. Tìm A?
A. Ba
B. Ca
C. Na
D. Cu
Đáp án B
nH2 = 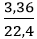
A + 2H2O → A(OH)2 + H2↑
0,15 ← 0,15 (mol)
mbazơ = 0,15. (MA + 17.2) = 11,1 g
⇔ MA + 34 = 74
⇔ MA = 40 (g/mol) → vậy A là Ca.
Câu 3: Tên gọi của Ba(OH)2:
A. Bari hiđroxit
B. Bari đihiđroxit
C. Bari hiđrat
D. Bari oxit
Đáp án A
Ba(OH)2: Bari hiđroxit
Câu 4: Cho mẩu Na vào nước thấy có 4,48 lít khí H2 (đktc) bay lên. Tính khối lượng Na đã tham gia phản ứng?
A. 9,2g
B. 4,6g
C. 2,0g
D. 9,6g
Đáp án A
Số mol khí hiđro là: nH2 = 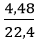
2Na + 2H2O → 2NaOH + H2↑
0,4 ← 0,2 (mol)
mNa = 0,4.23 = 9,2 gam
Câu 5: Cho 5,85 gam một kim loại M, có hóa trị I tác dụng hết với nước thoát ra 1,68 lít khí (đktc). Kim loại M là
A. Na.
B. K.
C. Ca.
D. Li.
Đáp án B
nH2 = 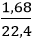
2M + 2H2O → 2MOH + H2↑
0,15 ← 0,075(mol)
⇒ MM = 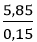
Câu 6: Hỗn hợp X gồm Na và Ba có khối lượng 32 gam. X tan hết trong nước thu được 6,72 lít khí H2 (đktc). Khối lượng Na có trong hỗn hợp X là:
A. 4,6 gam
B. 2,3 gam
C. 6,9 gam
D. 11,5 gam
Đáp án A
2Na + 2H2O → 2NaOH + H2↑
x 0,5x (mol)
Ba + 2H2O → Ba(OH)2 + H2↑
y y (mol)
Gọi nNa = x mol; nBa = y mol ⇒ mhỗn hợp = 23x + 137y = 32 gam (1)
Theo phương trình: nH2 = 0,5x + y = 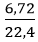
Thế y = 0,3 – 0,5x vào (1) ta được: 23x + 137.(0,3 - 0,5x) = 32 gam
Tính được : x = 0,2mol; y = 0,3 - 0,5.0,2 = 0,2mol
⇒ mNa = nNa.MNa = 0,2.23 = 4,6 gam.
Câu 7: Cho 4,6 gam Na tác dụng hoàn toàn với nước. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là:
A. 3,36 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 6,72 lít.
Đáp án B
2Na + 2H2O → 2NaOH + H2↑
nNa = 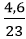
nH2 = 0,5 nNa = 0,1mol
VH2 = 0,1.22,4 = 2,24 lít
Câu 8: Cho 6,85 gam bari tác dụng với 100 gam nước. Tính C% của dung dịch thu được?
A. 4%
B. 6%
C. 8%
D. 10%
Đáp án C
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2↑
Ta có: nBa(OH)2 = nBa = 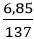
⇒ mBa(OH)2 = 0,05.171 = 8,55 g
nH2 = nBa = 0,05 mol
Áp dụng định luật bảo toàn khối lượng ta có :
mdd sau p/ư = mBa + mH2O − mH2 = 6,85+ 100 – 0,05.2 = 106,75gam.
⇒ C% Ba(OH)2 = 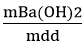
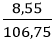
Câu 9: Cho 10 gam một kim loại M, có hóa trị II tác dụng hết với nước thoát ra 5,6 lít khí (đktc). Kim loại M là:
A. Ba.
B. Mg.
C. Ca.
D. Sr.
Đáp án C
nH2 = 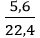
M + 2H2O → M(OH)2 + H2↑
0,25 ← 0,25 (mol)
⇒ MM =