Cách giải bài tập oxi tác dụng với hợp chất cực hay, có đáp án
Cách giải bài tập oxi tác dụng với hợp chất cực hay, có đáp án
Haylamdo biên soạn và sưu tầm Cách giải bài tập oxi tác dụng với hợp chất cực hay, có đáp án môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
- Oxi có thể tác dụng với các chất có tính khử hoặc các hợp chất hữu cơ để tạo thành những hợp chất mới, ví dụ:
O2 + 2SO2 
2O2 + CH4 
3O2 + C2H5OH 
(CH4 là khí metan, C2H5OH là rượu etylic sẽ được học ở lớp 9)
- Các bước giải:
+ Tính số mol các chất đã cho.
+ Viết phương trình hóa học.
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm.
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Khi đốt khí metan (CH4); khí axetilen (C2H2), rượu etylic (C2H6O) đều cho sản phẩm là khí cacbonic và hơi nước. Hãy viết phương trình hóa học biểu diễn sự cháy của các chất trên.
Hướng dẫn giải:
CH4 + 2O2 
2C2H2 + 5O2 
C2H6O + 3O2 
Ví dụ 2: Đốt cháy hoàn toàn m1 gam khí etilen (C2H4) cần 7,392 lít khí oxi (đktc), thu được m2 gam khí CO2 và m3 gam khí H2O. Tính m1 + m2 + m3.
Hướng dẫn giải:
Số mol khí O2 là: nO2 = 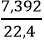
PTHH: C2H4 + 3O2 
0,11 ....... 0,33 (mol)
m1 = mC2H4 = 0,11.(12.2+4) = 3,08 g
mO2 = 0,33.32 = 10,56g
Áp dụng định luật bảo toàn khối lượng ta có:
mC2H4 + mO2 = mCO2 + mH2O
=> mCO2 + mH2O = 3,08 + 10,56 = 13,64 hay m2 + m3 = 13,64 g
Vậy m1 + m2 + m3 = mC2H4 + mCO2 + mH2O = 3,08+13,64 = 16,72 gam.
Ví dụ 3: Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 9,6 gam khí oxi. Khí sinh ra có 8,8 gam CO2.
a. Viết các phương trình hóa học xảy ra.
b. Tính khối lượng H2 trong hỗn hợp khí ban đầu
Hướng dẫn giải:
a. Phương trình hóa học:
2CO + O2 
2H2 + O2 
b. nCO2 = 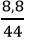
2CO + O2 
0,1 ← 0,2 (mol)
mO2 (1) = 0,1.32 = 3,2g
mO2 (2) = 9,6 – 3,2 = 6,4g => nO2 (2) = 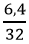
2H2 + O2 
0,4 ← 0,2 (mol)
mH2 = 0,4.2 = 0,8g.
C. Bài tập vận dụng
Câu 1: Đốt cháy hoàn toàn khí metan (CH4) trong khí oxi (vừa đủ). Sản phẩm của phản ứng là
A. CO2.
B. H2O.
C. CO2 và H2O.
D. CO2 , H2O và O2.
Đáp án C
Phương trình hóa học: CH4 + 2O2 
Sản phẩm thu được là: CO2 và H2O
Câu 2: Đốt cháy hoàn toàn 32 gam khí metan (CH4) cần V lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của V là?
A. 22,4 lít
B. 8,96 lít
C. 44,8 lít
D. 67,2 lít
Đáp án B
Số mol khí CH4 là: nCH4 = 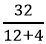
CH4 + 2O2 
2 → 4 (mol)
Thể tích khí oxi cần dùng là: VO2 = 22,4.4 = 89,6 lít.
Câu 3: Đốt cháy hoàn toàn m gam khí axetilen (C2H2) trong khí oxi, thu được 11,2 lít khí CO2 (đktc) và m2 gam H2O. Giá trị m2 là:
A. 5,4 gam.
B. 9,0 gam.
C. 4,5 gam.
D. 2,7 gam.
Đáp án C.
Số mol khí CO2 là: nCO2 = 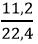
Phương trình hóa học: 2C2H2 + 5O2 
0,5 → 0,25 (mol)
Khối lượng nước thu được là: m2 = 0,25.18 = 4,5 gam.
Câu 4: Tính thể tích không khí ở đktc cần để oxi hóa hoàn toàn 20 lít khí NO (đktc) thành NO2
A. 10 lít.
B. 50 lít.
C. 60 lít.
D. 70 lít.
Đáp án B.
2NO + O2 
nO2 = 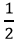
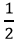
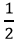
Vì Vkk = 5VO2 => Vkk = 5.10 = 50 (lít).
Câu 5: Đốt cháy hoàn toàn một hỗn hợp khí Z gồm CO và H2 cần dùng 4,48 lít khí O2. Hỗn hợp khí sinh ra có 3,36 lít CO2. Thể tích H2 trong hỗn hợp ban đầu là (biết thể tích các khí đều ở đktc)
A. 7,2 lít.
B. 5,6 lít.
C. 2,24 lít.
D. 4,48 lít.
Đáp án B
nCO2 = 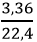
nO2 = 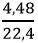
2CO + O2 
2H2 + O2 
Theo phương trình (1): nO2 (1) = 0.5.nCO2 = 0,075 mol
nO2 (2) = 0,2 – 0,075 = 0,125 mol
Theo phương trình (2): nH2 = 2nO2 = 0,25 mol
VH2 = 0,25.22,4 = 5,6 lít
Câu 6: Đốt cháy hoàn toàn 3,36 lít CH4 (đktc). Xác định thể tích không khí cần dùng cho phản ứng trên (đktc).
A. 72 lít.
B. 56 lít.
C. 22,4 lít.
D. 33,6 lít.
Đáp án D.
nCH4 = 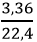
CH4 + 2O2 
0,15 → 0,3 (mol)
nO2= 0,3 (mol) → VO2= 0,3 . 22,4 = 6,72 (lít)
Vì VKK = 5VO2 → VKK = 5 . 6,72 = 33,6 (lít).
Câu 7: Đốt cháy hoàn toàn V lít khí metan CH4 (đktc) thu đươc 1,8g hơi nước. Xác định V?
A. 7,2 lít.
B. 5,6 lít.
C. 2,24 lít.
D. 1,12 lít.
Đáp án D.
nH2O = 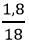
CH4 + 2O2 
0,05 ← 0,1 (mol)
VCH4 = 0,05.22,4 = 1,12 lít.
Câu 8: Đốt cháy hoàn toàn khí etilen (C2H4), thu được 15,5g hỗn hợp sản phẩm gồm khí cacbonic và hơi nước. Thể tích khí etilen (đktc) đã đốt cháy là
A. 9,64 lít.
B. 2,8 lít.
C. 5,6 lít.
D. 3,94 lít.
Đáp án B.
Gọi nC2H4 = a mol
C2H4 + 3O2 
a → 2a 2a (mol)
mCO2 + mH2O = 2a.(44+18) = 124a = 15,5g
→ a = 0,125 mol
VC2H4 = 0,125.22,4 = 2,8 lít
Câu 9: Cho 6,72 lít khí C2H2 (đktc) phản ứng hết với khí oxi thu được khí cacbonic và hơi nước. Thể tích khí oxi cần dùng (đktc) là
A. 22,4 lít.
B. 13,44 lít.
C. 15,68 lít.
D. 16,8 lít.
Đáp án D.
nC2H2 = 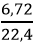
2C2H2 + 5O2 
0,3 → 0,75 (mol)
VO2 = 0,75.22,4 = 16,8 lít
Câu 10: Đốt cháy hoàn toàn m gam khí metan (CH4) cần 6,72 lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của m là?
A. 0,8 gam
B. 0,4 gam
C. 1,6 gam
D. 0,6 gam
Đáp án A.
nO2 = 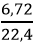
CH4 + 2O2 
0,15 ← 0,3 (mol)
mCH4 = 0,05.16 = 0,8 gam

