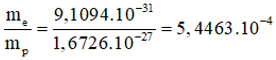Cách giải bài tập tính khối lượng nguyên tử cực hay, có đáp án
Cách giải bài tập tính khối lượng nguyên tử cực hay, có đáp án
Haylamdo biên soạn và sưu tầm Cách giải bài tập tính khối lượng nguyên tử cực hay, có đáp án môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
- Khối lượng của các hạt cấu tạo nên nguyên tử:
+) Khối lượng của một electron: me = 9,1094.10-31 kg.
+) Khối lượng của một proton: mp = 1,6726.10-27 kg.
+) Khối lượng của một nơtron: mn = 1,6748.10-27 kg.
Nhận xét: Proton và nơtron có khối lượng xấp xỉ nhau và chúng lớn hơn khối lượng của electron khoảng 1836 lần, do đó có thể coi khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử (khối lượng của các electron là không đáng kể, có thể bỏ qua).
- Nguyên tử có khối lượng vô cùng nhỏ bé, nếu tính bằng đơn vị gam thì số trị quá bé, không tiện sử dụng. Do đó, quy ước lấy 1/12 khối lượng của nguyên tử C làm đơn vị khối lượng cho nguyên tử, gọi là đơn vị cacbon, viết tắt là đvC, kí hiệu quốc tế là u.
Chú ý:
+) Khối lượng tính bằng đơn vị cacbon chỉ là khối lượng tương đối giữa các nguyên tử. Người ta gọi khối lượng này là nguyên tử khối.
Nguyên tử khối là khối lượng của một nguyên tử tính theo đơn vị cacbon.
1 đvC = 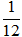
⇒ 1 đvC = 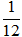
Vậy mp ≈ mn ≈ 1u; me ≈ 0,00055u.
+) Nguyên tử hiđro có khối lượng nhẹ nhất.
+) Nguyên tử khối của một số nguyên tố hay gặp (trang 42 – SGK hóa học 8).
| Số proton | Tên nguyên tố | Kí hiệu hóa học | Nguyên tử khối | Hóa trị |
| 1 | Hiđro | H | 1 | I |
| 2 | Heli | He | 4 | |
| 3 | Liti | Li | 7 | I |
| 4 | Beri | Be | 9 | II |
| 5 | Bo | B | 11 | 11 III |
| 6 | Cacbon | C | 12 | IV, II |
| 7 | Nitơ | N | 14 | III, II, IV… |
| 8 | Oxi | O | 16 | II |
| 9 | Flo | F | 19 | I |
| 10 | Neon | Ne | 20 | |
| 11 | Natri | Na | 23 | I |
| 12 | Magie | Mg | 24 | II |
| 13 | Nhôm | Al | 27 | III |
| 14 | Silic | Si | 28 | IV |
| 15 | Photpho | P | 31 | III, V |
| 16 | Lưu huỳnh | S | 32 | II, IV,VI |
| 17 | Clo | Cl | 35,5 | I, … |
| 18 | Agon | Ar | 39,9 | |
| 19 | Kali | K | 39 | I |
| 20 | Canxi | Ca | 40 | II |
| . | ||||
| . | ||||
| . | ||||
| 24 | Crom | Cr | 52 | II, III, … |
| 25 | Mangan | Mn | 55 | II, IV, VII… |
| 26 | Sắt | Fe | 56 | II, III |
| 29 | Đồng | Cu | 64 | I, II |
| 30 | Kẽm | Zn | 65 | II |
| 35 | Brom | Br | 80 | I, … |
| 47 | Bạc | Ag | 108 | I |
| 56 | Bari | Ba | 137 | II |
| 80 | Thủy ngân | Hg | 201 | I, II |
| 82 | Chì | Pb | 207 | II, IV |
B. Ví dụ minh họa
Ví dụ 1: Biết nguyên tử nhôm có 13 proton, 14 nơtron. Khối lượng tính bằng gam của một nguyên tử nhôm là
A. 5,32.10-23g.
B. 6,02.10-23g.
C. 4,48.10-23g.
D. 3,99.10-23g.
Hướng dẫn giải:
Chọn C
mAl ≈ ∑mp + ∑mn = 13u + 14u = 27u.
Có 1u = 1,6605.10-27kg ⇒ mAl = 27. 1,6605.10-27.1000 = 4,48.10-27g.
Ví dụ 2: Hãy so sánh xem nguyên tử magie nặng hay nhẹ hơn bao nhiêu lần so với nguyên tử cacbon?
Hướng dẫn giải:
Nguyên tử khối của Mg là 24 đvC; nguyên tử khối của cacbon là 12 đvC.
⇒Nguyên tử magie nặng hơn 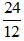
Ví dụ 3: Nguyên tử X nặng gấp 4 lần nguyên tử nitơ. Tính nguyên tử khối của X và cho biết X thuộc nguyên tố nào?
Hướng dẫn giải:
Nguyên tử khối của nitơ = 14 đvC
⇒ Nguyên tử khối của X = 4 x 14 = 56 (đvC)
Vậy X là nguyên tố sắt (Fe).
C. Bài tập vận dụng
Câu 1: Nguyên tử khối là
A. Khối lượng của nguyên tử tính bằng gam.
B. Khối lượng của phân tử tính bằng đvC.
C. Khối lượng của nguyên tử tính bằng đvC.
D. Khối lượng của phân tử tính bằng gam.
Chọn C.
Câu 2: Nguyên tử khối của clo là
A. 71 đvC.
B. 35,5 gam.
C. 71 gam.
D. 35,5 đvC.
Chọn D.
Câu 3: Khối lượng của một nguyên tử cacbon là 19,9265. 10-23 gam. Vậy ta có khối lượng của 1 đvC là
A. 8,553. 10-23 g.
B. 2,6605. 10-23 g.
C. 0,16605. 10-23 g.
D. 18,56. 10-23 g.
Chọn C.
⇒ 1 đvC = 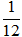
Câu 4: Biết rằng bốn nguyên tử Mg nặng bằng ba nguyên tử của nguyên tố X. Vậy tên của nguyên tố X là
A. Lưu huỳnh.
B. Sắt.
C. Nitơ.
D. Can xi.
Chọn A
Nguyên tử khối của Mg là 24 đvC. Đặt nguyên tử khối của X là M.
Theo bài ra, ta có: 4.24 = 3.M ⇒ M = 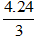
Vậy X là nguyên tố lưu huỳnh (S).
Câu 5: Khối lượng tương đối của một phân tử H2O là
A. 18 đvC.
B. 18 gam.
C.34 đvC.
D. 18kg.
Chọn A.
Khối lượng tương đối của một phân tử nước = MH2O = 2.1 + 16 = 18 (đvC).
Câu 6: Biết nguyên tử nitơ gồm có 7 proton, 7 nơtron và 7 electron. Khối lượng của toàn nguyên tử nitơ là
A. 14 gam.
B. 21 gam.
C. 2,34. 10-23 gam.
D. 2,34. 10-27 gam.
Chọn C.
Ta có:
mC = ∑mp + ∑me + ∑mn = 7. 1,6726.10-27 + 7. 9,1094.10-31 + 7.1,6748.10-27
= 2,34.10-26kg = 2,34.10-23 gam.
Câu 7: Trường hợp nào đưới đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. proton, m = 0,00055u, q = 1+.
B. nơtron, m = 1,0086u, q = 0.
C. electron, m = 1,0073u, q =1-.
D. proton, m = 1,0073u, q = 1-.
Chọn B.
A sai vì mp ≈ 1u.
C sai vì me ≈ 0,00055u.
D sai vì proton mang điện tích dương.
Câu 8: Một nguyên tử chỉ có 1 electron ở vỏ nguyên tử. Hạt nhân nguyên tử có khối lượng xấp xỉ 3u. Số hạt proton và hạt nơtron trong hạt nhân nguyên tử này lần lượt là
A. 1 và 0.
B. 1 và 2.
C. 1 và 3.
D. 3 và 0.
Chọn B.
Ta có: mP ≈ mn ≈ 1u
Tổng số hạt n và p trong hạt nhân nguyên tử này là: 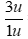
Nguyên tử có 1 electron ở lớp vỏ nguyên tử nên sẽ có 1 proton trong hạt nhân. Suy ra số hạt nơtron trong hạt nhân là 2.
Câu 9: Hai nguyên tử Mg nặng gấp mấy lần nguyên tử O?
A. 1.
B. 2.
C. 3.
D. 4.
Chọn C.
Khối lượng của 2 nguyên tử Mg là 2.24 = 48đvC.
Khối lượng của nguyên tử O là 16 đvC.
Tỉ lệ khối lượng của 2 nguyên tử Mg so với nguyên tử O là: 48 : 16 = 3 lần.
Vậy 2 nguyên tử magie nặng bằng 3 nguyên tử oxi.
Câu 10: Tỉ số về khối lượng của electron so với proton là
A. 1836.
B. 5,4463.
C. 5,4463.10-4.
D. 0,055.
Chọn C.
Tỉ số về khối lượng của electron so với proton là: