Cách xác định công thức hóa học của hợp chất khi biết thành phần các nguyên tố cực hay
Cách xác định công thức hóa học của hợp chất khi biết thành phần các nguyên tố cực hay
Haylamdo biên soạn và sưu tầm Cách xác định công thức hóa học của hợp chất khi biết thành phần các nguyên tố cực hay môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
Xác định công thức hoá học của hợp chất khi biết thành phần các nguyên tố
Gọi công thức tổng quát của hợp chất là AxBy
Bước 1: Tìm khối lượng mỗi nguyên tố có trong 1 mol hợp chất.
mA = 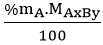
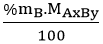
Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất.
nA = 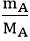
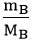
Bước 3: Lập công thức hóa học của hợp chất.
Lưu ý: Nếu đề bài không cho dữ kiện tính khối lượng mol, thực hiện như sau:
x : y = 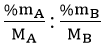
Công thức tìm được là công thức đơn giản nhất.
B. Ví dụ minh họa
Ví dụ 1: Một hơp chất có thành phần các nguyên tố là 40% Cu; 20% S và 40% O. Hãy xác định công thức hoá học của hợp chất (biết khối lượng mol của hợp chất là 160 g/mol)
Hướng dẫn giải:
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCu = 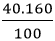
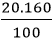
mO = 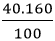
- Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nCu = 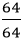
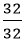
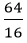
Suy ra trong 1 phân tử hợp chất có : 1 nguyên tử Cu, 1 nguyên tử S và 4 nguyên tử O.
Vậy công thức hoá học của hợp chất là: CuSO4
Ví dụ 2: : Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
Hướng dẫn giải:
Gọi công thức hóa học cần tìm của A là SxOy
A có tỉ khối so với khí H2 là 40: MSxOy = 40. MH2 = 40. 2 = 80 g/mol
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mS = 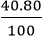
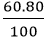
- Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là:
nS = 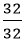
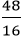
Suy ra trong 1 phân tử hợp chất có 1 nguyên tử S và 3 nguyên tử O.
Vậy công thức hoá học của hợp chất là: SO3
Ví dụ 3: Hợp chất A chứa Ca, C và O. Biết thành phần phần trăm về khối lượng của các nguyên tố Ca, C, O lần lượt là: 40%, 12%, 48%. Lập công thức hóa học của A biết khối lượng mol của hợp chất là: 100 g/mol.
Hướng dẫn giải:
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCa = 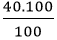
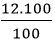
mO = 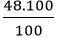
- Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là:
nCa = 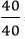
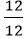
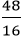
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O.
Vậy công thức hoá học của hợp chất là: CaCO3
C. Bài tập vận dụng
Câu 1: Cho hợp chất C2H5OH. Số mol nguyên tử H có trong 1 mol hợp chất là:
A. 1 mol
B. 5 mol
C. 3 mol
D. 6 mol
Đáp án D
Trong hợp chất C2H5OH chứa 6 nguyên tử H nên trong 1 mol phân tử hợp chất có chứa 6 mol nguyên tử H.
Câu 2: Hợp chất A có khối lượng mol là 94 g/mol, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là
A. KO2
B. KO
C. K2O
D. KOH
Đáp án C
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mK = 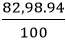
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nK = 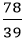
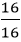
Vậy công thức hoá học của hợp chất là K2O
Câu 3: A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15, biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là:
A. CH4
B. C3H6
C. C2H6
D. C2H2
Đáp án C
A tỉ khối hơi đối với H2 là 15: MA = dA/H2. MH2 = 15. 2 = 30 g/mol
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mc = 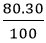
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nC = 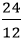
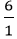
Vậy công thức hoá học của hợp chất là C2H6
Câu 4: Biết hợp chất A có tỉ khối so với khí hiđro là 22. Xác định công thức của hợp chất, biết chỉ có duy nhất 1 nguyên tử Oxi.
A. NO
B. CO
C. N2O
D. CO2
Đáp án C
dA/H2 = 22 → MA = dA/H2.MH2 = 22.2 = 44 g/mol
A có 1 nguyên tử O → Loại đáp án D
Loại A do MNO = 14 + 16 = 30 g/mol
Loại B do MCO = 12 + 16 = 28 g/mol
Chọn C do MN2O= 14.2 + 16 = 44 g/mol
Câu 5: Tìm công thức hóa học biết chất A có 80% nguyên tử Cu và 20% nguyên tử Oxi, biết khối lượng mol của A là 80 g/mol
A. CuO2
B. CuO
C. Cu2O
D. Cu2O2
Đáp án B
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCu = 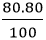
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nCu = 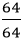
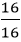
Suy ra trong 1 phân tử hợp chất có 1 nguyên tử Cu và 1 nguyên tử O.
Vậy công thức hoá học của hợp chất là CuO
Câu 6: Một hợp chất khí có thành phần phần trăm theo khối lượng là: 82,35%N và 17,65% H. Hãy cho biết công thức hóa học của hợp chất, biết tỉ khối của A so với khí hiđro là 8,5?
A. N3H.
B. NH3.
C. NH2.
D. N2H.
Đáp án B
Tỉ khối của A so với khí hiđro là 8,5: MA = dA/H2.MH2 = 8,5.2 = 17 g/mol
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = 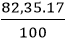
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = 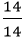
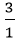
Suy ra trong 1 phân tử hợp chất có 1 nguyên tử N và 3 nguyên tử H.
Vậy công thức hoá học của hợp chất là NH3
Câu 7: Một hợp chất gồm 2 nguyên tố kết hợp với nhau theo tỉ lệ khối lượng là 3 phần magie với 4 phần lưu huỳnh. Tìm công thức hóa học đơn giản của hợp chất đó?
A. MgS.
B. Mg2S.
C. MgS2.
D. Mg2S2.
Đáp án A
Số mol Mg kết hợp với lưu huỳnh: nMg = 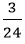
Số mol S kết hợp với magie: nS = 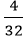
Vậy 0,125 mol nguyên tử Mg kết hợp với 0,125 mol nguyên tử S
→ 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S
Nên công thức hóa học đơn giản của hợp chất là MgS
Câu 8: Phân tích một khối lượng hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức đơn giản của hợp chất M là:
A. SO2
B. SO3
C. SO4
D. S2O3
Đáp án A
Gọi công thức của oxit là SxOy
x : y = nS : nO = 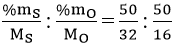
Vậy công thức đơn giản của hợp chất M là: SO2
Câu 9: Cho một oxit biết oxit đó chứa 20% oxi về khối lượng và nguyên tố chưa biết trong oxit có hoá trị II. Oxit có công thức hoá học là:
A. MgO
B. ZnO
C. CuO
D. FeO
Đáp án C
Gọi công thức của oxit là RO (vì theo bài ra nguyên tố R có hóa trị II)
%mO = 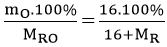
=> 20.(16+MR) = 16.100
=> MR = 64 g/mol; R là Cu.
Câu 10: Hợp chất A có khối lượng mol là 58,5 g/mol. Thành phần phần trăm theo khối lượng của các nguyên tố trong A là: 60,68% Cl, còn lại là Na. Công thức hóa học của hợp chất là:
A. NaCl
B. NaCl2
C. Na2Cl
D. Na2Cl2
Đáp án A
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCl = 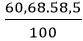
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nCl = 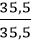
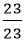
Vậy công thức hoá học của hợp chất là NaCl

