Cách giải bài tập oxit tác dụng với nước cực hay, chi tiết
Cách giải bài tập oxit tác dụng với nước cực hay, chi tiết
Haylamdo biên soạn và sưu tầm Cách giải bài tập oxit tác dụng với nước cực hay, chi tiết môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
1. Nước tác dụng với oxit bazơ
+ Nước có thể tác dụng với một số oxit bazơ như K2O, Na2O, CaO, BaO… tạo ra dung dịch bazơ tương ứng.
+ Dung dịch bazơ làm đổi màu quỳ tím thành xanh.
Ví dụ:
CaO + H2O → Ca(OH)2
Lưu ý: phản ứng trên còn gọi là phản ứng tôi vôi, dung dịch Ca(OH)2 gọi là nước vôi trong.
2. Nước tác dụng với oxit axit
+ Nước tác dụng với oxit axit như SO2, P2O5,... tạo ra axit tương ứng
+ Dung dịch axit làm đổi màu quỳ tím thành đỏ.
Ví dụ: P2O5 + 3H2O → 2H3PO4
Các bước giải toán:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Lập phương trình hóa học của các phản ứng sau:
(1) Cacbon đioxit + nước → Axit cacbonic (H2CO3)
(2) Lưu huỳnh đioxit +nước → Axit sunfurơ (H2SO3)
(3) Natri oxit + nước → natri hiđroxit (NaOH)
(4) Bari oxit + nước → bari hiđroxit (Ba(OH)2)
Lời giải
(1) CO2 + H2O → H2CO3
(2) SO2 + H2O → H2SO3
(3) Na2O + H2O → 2NaOH
(4) BaO + H2O → Ba(OH)2
Ví dụ 2: Cho 12,4 gam natri oxit tác dụng hết với nước.
a) Viết phương trình hóa học.
b) Tính khối lượng natri hiđroxit có trong dung dịch thu được.
Lời giải
a) Phương trình hóa học: Na2O + H2O → 2NaOH
b) Số mol Na là: nNa2O = 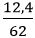
Na2O + H2O → 2NaOH
0,2 → 0,4 (mol)
Theo phương trình: nNaOH = 2nNa2O = 0,4 mol
Khối lượng natri hiđroxit có trong dung dịch thu được là:
mNaOH = nNaOH.MNaOH = 0,4.40 = 16 gam
Ví dụ 3: Hòa tan hỗn hợp gồm (28,4 gam P2O5 và 12 gam SO3) vào nước dư, thu được dung dịch chứa bao nhiêu gam chất tan?
Lời giải
Số mol P2O5 là: nP2O5 = 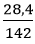
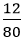
Phương trình hóa học:
P2O5 + 3H2O → 2H3PO4
0,2 → 0,4 (mol)
Khối lượng H3PO4 là: mH3PO4 = nH3PO4.MH3PO4 = 0,4.98 = 39,2 gam
SO3 + H2O → H2SO4
0,15 → 0,15 (mol)
Khối lượng H2SO4 là: mH2SO4 = nH2SO4.MH2SO4 = 0,15.98 = 14,7 gam
Tổng khối lượng H3PO4 và H2SO4 có trong dung dịch thu được là:
mhh = 39,2 + 14,7 = 53,9 gam.
C. Bài tập vận dụng
Câu 1: Oxit bazơ nào sau đây không tác dụng với nước:
A. BaO
B. Na2O
C. CaO
D. Al2O3
Đáp án D
Nước có thể tác dụng với một số oxit bazơ như K2O, Na2O, CaO, BaO … tạo ra bazơ ⇒ Oxit bazơ không tác dụng với nước là: Al2O3.
Câu 2: Cho CaO tác dụng với nước thu được dung dịch nước vôi trong. Cho quỳ tím vào nước vôi trong, hiện tượng xảy ra là:
A. Quỳ tím chuyển màu đỏ
B. Quỳ tím không đổi màu
C. Quỳ tím chuyển màu xanh
D. Không có hiện tượng
Đáp án C
Nước vôi trong là dung dịch Ca(OH)2: dung dịch bazơ
⇒ làm quỳ tím chuyển sang màu xanh.
Câu 3: Oxit tác dụng với nước tạo ra dung dịch làm quỳ tím hóa xanh là:
A. CO2
B. P2O5
C. Na2O
D. CuO
Đáp án C
Na2O + H2O → 2NaOH
Dung dịch NaOH là dung dịch bazơ nên có thể làm quỳ tím chuyển xanh
Câu 4: Cho oxit A tác dụng với nước tạo axit nitric. Xác định A, biết MA = 108 g/mol, trong A có 2 nguyên tử nitơ.
A. NO2
B. N2O3
C. N2O
D. N2O5
Đáp án D
Trong A có 2 nguyên tử nitơ ⇒ gọi công thức của A có dạng N2On
Theo đầu bài: MA = 108 g/mol ⇒ 14.2 + 16.n = 108 ⇒ n = 5.
Vậy công thức hóa học của A là: N2O5
N2O5 + H2O → 2HNO3
Câu 5: Cho nước tác dụng với SO3 thu được dung dịch A. Khi cho quỳ tím vào dung dịch A, quỳ tím chuyển sang màu gì?
A. Đỏ
B. Xanh
C. Tím
D. Không màu
Đáp án A
SO3 + H2O → H2SO4
Sau phản ứng thu được dung dịch axit. Khi cho quỳ tím vào dung dịch axit, quỳ tím chuyển màu đỏ
Câu 6: Hòa tan 21,3 gam P2O5 vào nước dư, thu được dung dịch chứa bao nhiêu gam chất tan?
A. 14,7 gam.
B. 29,4 gam.
C. 44,1 gam.
D. 19,6 gam.
Đáp án B
Số mol P2O5 là: nP2O5 = 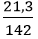
Phương trình hóa học:
P2O5 + 3H2O → 2H3PO4
0,15 → 0,3 (mol)
Khối lượng H2PO4 thu được là:
mH3PO4 = nH3PO4.MH3PO4 = 0,3.98 = 29,4gam
Câu 7: Cho các oxit sau: CuO, K2O, CaO, SiO2, SO2. Số oxit không tác dụng được với nước là
A. 1.
B. 2.
C. 3.
D. 4.
Chọn B
Hai oxit không tác dụng với nước là CuO và SiO2.
Câu 8: Hòa tan 11,28 gam K2O vào nước dư, thu được dung dịch chứa m gam KOH. Tính m ?
A. 6,72 gam.
B. 13,44 gam.
C. 8,40 gam.
D. 8,96 gam.
Đáp án B
Số mol K2O là: nK2O = 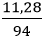
K2O + H2O → 2KOH
0,12 → 0,24 (mol)
Khối lượng KOH có trong dung dịch thu được là:
mKOH = nKOH.MKOH = 0,24.56 = 13,44 gam.
Câu 9: Hòa tan một lượng BaO vào nước dư thu được dung dịch chứa 17,1 gam Ba(OH)2. Tính khối lượng BaO đã phản ứng?
A. 30,6 gam.
B. 15,3 gam.
C. 20,4 gam.
D. 26,48 gam.
Đáp án B
Số mol Ba(OH)2 là: nBa(OH)2 = 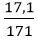
BaO + H2O → Ba(OH)2
0,1 ← 0,1 (mol)
Khối lượng BaO đã phản ứng là:
mBaO = nBaO.MBaO = 0,1.153 = 15,3 gam
Câu 10: Hòa tan hỗn hợp gồm (12,4 gam Na2O và 15,3 gam BaO) vào nước dư, thu được dung dịch chứa m gam hỗn hợp NaOH và Ba(OH)2. Tính m?
A. 33,1 gam.
B. 17,1 gam.
C. 49,65 gam.
D. 26,48 gam.
Đáp án A
nNa2O = 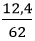
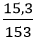
Na2O + H2O → 2NaOH
0,2 → 0,4 (mol)
Khối lượng NaOH có trong dung dịch thu được là: mNaOH = 0,4.40 = 16 gam
BaO + H2O → Ba(OH)2
0,1 → 0,1 (mol)
Khối lượng Ba(OH)2 có trong dung dịch là: mBa(OH)2 = 0,1.171 = 17,1 gam
Tổng khối lượng NaOH và Ba(OH)2 có trong dung dịch là:
m = 16 + 17,1 = 33,1 gam.

