Bài tập về điều chế hidro cực hay, có lời giải
Bài tập về điều chế hidro cực hay, có lời giải
Haylamdo biên soạn và sưu tầm Bài tập về điều chế hidro cực hay, có lời giải môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
Lý thuyết cần nắm vững về phương pháp điều chế hiđro:
1. Trong phòng thí nghiệm
- Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm,…)
Ví dụ: Zn + 2HCl → ZnCl2 + H2
- Thu khí hiđro bằng cách đẩy nước hay đẩy không khí.
2. Trong công nghiệp
- Phương pháp điện phân nước.
2H2O điện phân→ 2H2↑ + O2↑
- Dùng than khử oxi của H2O ở nhiệt độ cao: C + H2O 
- Sản xuất từ khí tự nhiên, khí mỏ dầu.
Các bước giải toán:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
B. Ví dụ minh họa
Ví dụ 1: Những phản ứng hóa học nào dưới đây thường dùng để điều chế hiđro trong phòng thí nghiệm?
a. Zn + H2SO4 → ZnSO4 + H2↑
b. 2H2O điện phân→ 2H2↑ + O2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Lời giải
Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại như Zn, Fe, Al.
Những phản ứng hóa học thường dùng để điều chế hiđro trong phòng thí nghiệm là:
a. Zn + H2SO4 → ZnSO4 + H2↑
c. 2Al + 6HCl → 2AlCl3 + 3H2↑
d. Fe + H2SO4 → FeSO4 + H2↑
Ví dụ 2: Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H2SO4 loãng. Hãy viết các phương trình hóa học có thể điều chế hiđro.
Lời giải
Phương trình hóa học có thể điều chế hiđro:
Zn + 2HCl → ZnCl2 + H2 ↑
Zn + H2SO4 (loãng) → ZnSO2 + H2 ↑
Fe + H2SO4 (lãong) → FeSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
Ví dụ 3: Trong giờ thực hành hóa học, học sinh A cho 32,5 gam kẽm vào dung dịch H2SO4 loãng, trong khí đó học sinh B cho 32,5 gam sắt cũng vào dung dịch H2SO4 loãng như ở trên. Hãy cho biết học sinh A hay học sinh B thu được nhiều khí hiđro (đo ở đktc) hơn?
Lời giải
Học sinh A:
Số mol Zn là: nZn = 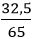
Zn + H2SO4 → ZnSO4 + H2↑
0,5 → 0,5 (mol)
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,5 = 11,2 lít
Học sinh B:
Số mol Fe là: nFe = 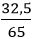
Fe + H2SO4 → FeSO4 + H2↑
0,58 → 0,58 (mol)
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,58 = 12,99 lít.
Vậy học sinh B thu được nhiều khí hiđro hơn.
C. Bài tập vận dụng
Câu 1: Hiện tượng khi cho viên kẽm (Zn) vào dung dịch axit clohiđric (HCl) là
A. có kết tủa trắng.
B. có thoát khí màu nâu đỏ.
C. dung dịch có màu xanh lam.
D. viên kẽm tan dần, có khí không màu thoát ra.
Đáp án D
Hiện tượng khi cho viên kẽm (Zn) vào dung dịch axit clohiđric (HCl) là: viên kẽm tan dần, có khí không màu thoát ra.
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2↑
Câu 2: Phản ứng nào dưới đây có thể tạo được khí hiđro?
A. Cu + HCl
B. CaO + H2O
C. Fe + H2SO4 loãng
D. CuO + HCl
Đáp án C
Phản ứng tạo được khí hiđro là: Fe + H2SO4 → FeSO4 + H2↑
Chú ý: Cu không tác dụng với HCl.
Câu 3: Có mấy phương pháp thu khí hiđro trong phòng thí nghiệm?
A. 1
B. 2
C. 3
D. 4
Đáp án B
Có 2 phương pháp thu khí hiđro trong phòng thí nghiệm là phương pháp đẩy nước và phương pháp đẩy không khí.
Câu 4: Dung dịch axit được dùng để điều chế hiđro trong phòng thí nghiệm là:
A. H2SO4 đặc
B. HNO3 loãng
C. H2SO4 loãng
D. A và B đều đúng
Đáp án C
Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại như Zn, Fe, Al.
Câu 5: Sản xuất hiđro trong công nghiệp bằng cách nào sau đây?
A. từ thiên nhiên – khí dầu mỏ.
B. điện phân nước.
C. từ nước và than.
D. cả 3 cách trên.
Đáp án D
Trong công nghiệp, sản xuất hiđro bằng cách:
- Phương pháp điện phân nước : 2H2O điện phân→ 2H2↑ + O2↑
- Dùng than khử oxi của H2O ở nhiệt độ cao: C + H2O 
- Điều chế từ khí tự nhiên, khí mỏ dầu.
Câu 6: Cho Zn phản ứng với HCl, khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Đỏ
B. Xanh nhạt
C. Cam
D. Tím
Đáp án B
Phản ứng của Zn với HCl:
Zn + 2HCl → ZnCl2 + H2↑
Khí thoát ra là H2, cháy được trong không khí với ngọn lửa màu xanh nhạt.
Câu 7: Cho Al tác dụng hoàn toàn với H2SO4 loãng, sau phản ứng tạo ra mấy sản phẩm?
A. 2
B. 1
C. 3
D. 4
Đáp án A
Phương trình hóa học: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
→ Phản ứng tạo ra 2 sản phẩm.
Câu 8: Cho 6,5 gam Zn phản ứng với lượng dư axit clohiđric (HCl) thấy có khí bay lên. Tính thể tích khí ở đktc?
A. 2,24 lít.
B. 0,224 lít.
C. 22,4 lít.
D. 4,48 lít.
Đáp án A
Số mol Zn là: nZn = 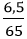
Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,1 (mol)
Thể tích khí thu được là: VH2 = 22,4.nH2 = 22,4.0,1 = 2,24 lít
Câu 9: Tính khối lượng của Al đã phản ứng với axit sunfuric (H2SO4), biết sau phản ứng thu được 1,68 lít khí (đktc).
A. 2,025 gam
B. 5,240 gam
C. 6,075 gam
D. 1,350 gam
Đáp án D
Số mol H2 là: nH2 = 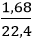
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)2 + 3H2↑
0,05 ← 0,075 (mol)
Khối lượng Al đã phản ứng là: mAl = nAl.MAl = 0,05.27 = 1,35 gam.
Câu 10: Cho một thanh sắt nặng 5,6 gam vào bình đựng dung dịch axit clohiđric loãng, dư thu được dung dịch A và khí bay lên. Cô cạn dung dịch A được m gam muối rắn. Hỏi muối là gì và tìm m?
A. FeCl2; m = 12,7 gam
B. FeCl2; m = 17,2 gam
C. FeCl3; m = 55,3 gam
D. Không xác định được
Đáp án A
Số mol Fe là: nFe = 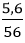
Fe + 2HCl → FeCl2 + H2↑
0,1 → 0,1 (mol)
Cô cạn dung dịch A thu được muối rắn là FeCl2
Khối lượng FeCl2 thu được là:
mFeCl2 = nFeCl2.MFeCl2 = 0,1.127 =12,7gam

