Cách làm bài tập hidro tác dụng với oxit kim loại cực hay, chi tiết
Cách làm bài tập hidro tác dụng với oxit kim loại cực hay, chi tiết
Haylamdo biên soạn và sưu tầm Cách làm bài tập hidro tác dụng với oxit kim loại cực hay, chi tiết môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
1. Lý thuyết cần nắm vững:
- Hiđro có tính khử, có thể tác dụng với một số oxit kim loại ở nhiệt độ cao.
Ví dụ:
H2 + CuO (đen) 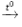
3H2 + Fe2O3 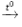
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3.
2. Các bước giải:
+ Tính số mol các chất đã cho
+ Viết phương trình hóa học, cân bằng phản ứng.
+ Xác định chất dư, chất hết (nếu có), tính toán theo chất hết, (nếu oxit còn dư thì chất rắn sau phản ứng gồm oxit dư và kim loại tạo thành)
+ Tính khối lượng hoặc thể tích các chất theo yêu cầu đề bài.
- Nắm vững kiến thức về lập phương trình hóa học, cân bằng hóa học và các công thức chuyển đổi khối lượng, thể tích.
- Áp dụng định luật bảo toàn khối lượng: mtham gia = msản phẩm
- Nếu bài cho số liệu số mol cả chất tham gia phản ứng và chất sản phẩm thì tính toán theo chất sản phẩm.
B. Ví dụ minh họa
Ví dụ 1: Khử hoàn toàn 24 gam đồng (II) oxit bằng khí hiđro. Hãy:
a. Tính số gam đồng kim loại thu được;
b. Tính thể tích khí hiđro (đktc) cần dùng.
Lời giải
Số mol CuO: nCuO = 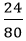
H2 + CuO 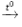
a. Theo phương trình, nCu = nCuO = 0,3 mol
Khối lượng đồng kim loại thu được: mCu = nCu.MCu = 0,3.64 = 19,2 gam
b. Theo phương trình, nH2 = nCuO = 0,3 mol
Thể tích khí hiđro cần dùng ở đktc là: VH2 = 22,4.nH2 = 22,4.0,3 = 6,72 lít.
Ví dụ 2: Trong phòng thí nghiệm người ta dùng hiđro để khử sắt (III) oxit và thu được 11,2 g sắt.
a) Viết phương trình hóa học của các phản ứng đã xảy ra
b) Tính khối lượng sắt (III) oxit đã phản ứng.
Lời giải
a) Phương trình phản ứng hóa học:
Fe2O3 + 3H2 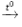
b) Số mol sắt thu được: nFe = 
Fe2O3 + 3H2 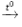
0,1 ← 0,2 (mol)
Khối lượng oxit sắt tham gia phản ứng:
mFe2O3 = nFe2O3 . MFe2O3 = 0,1.(56.2+16.3) = 16 gam.
Ví dụ 3: Khử hoàn toàn 8 gam một oxit của kim loại R (có hoá trị II) cần vừa đủ 2,24 lít H2 (đktc). Xác định kim loại R?
Lời giải
Gọi công thức của oxit là RO (vì R có hóa trị II)
nH2 = 
Phương trình hóa học:
RO + H2 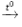
0,1 ← 0,1 (mol)
Khối lượng của oxit: mRO = nRO.MRO = 0,1.(MR +16) = 8 gam
→ MR +16 = 80 → MR = 64 (g/mol).
Vậy kim loại cần tìm là đồng (kí hiệu hóa học: Cu).
C. Bài tập vận dụng
Câu 1: Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị hiđro khử?
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Đáp án D
H2 không tác dụng với các oxit: Na2O, K2O, CaO...
Câu 2: Trong những oxit sau: CuO, MgO, Al2O3, Ag2O, Na2O, PbO. Có bao nhiêu oxit phản ứng với hiđro ở nhiệt độ cao?
A. 4
B. 5
C. 3
D. 1
Đáp án C
- H2 không tác dụng với các oxit: Na2O, K2O, BaO, CaO, MgO, Al2O3
→ Những oxit phản ứng với hiđro ở nhiệt độ cao là: CuO, Ag2O, PbO.
Câu 3: Sau phản ứng của CuO với H2 thì có hiện tượng gì?
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam.
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ.
C. Có chất khí bay lên.
D. Không có hiện tượng.
Đáp án B
H2 + CuO (đen) 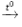
Câu 4: Một sản phẩm thu được sau khi dẫn khí hiđro qua chì (II) oxit nung nóng là
A. Pb
B. H2
C. PbO
D. Không phản ứng
Đáp án A
H2 + PbO 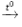
Câu 5: Tính thể tích hiđro (đktc) cần dùng để điều chế 5,6 gam Fe từ FeO?
A. 2,24 lít.
B. 1,12 lít.
C. 3,36 lít.
D. 4,48 lít.
Đáp án A
nFe = 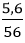
Phương trình hóa học:
FeO + H2 
0,1 ← 0,1 (mol)
Thể tích hiđro cần dùng là: VH2 = 22,4.nH2 = 0,1.22,4 = 2,24 lít
Câu 6: Cho CuO tác dụng hết với 1,12 lít khí H2 ở nhiệt độ cao. Sau phản ứng thấy có m gam kim loại. Giá trị của m là:
A. 6,4 gam
B. 3,2 gam
C. 0,72 gam
D. 7,2 gam
Đáp án B
nH2 = 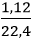
H2 + CuO 
0,05 → 0,05 (mol)
mCu = nCu.MCu = 0,05.64 = 3,2 gam
Câu 7: Người ta điều chế 24 gam đồng bằng cách dùng H2 khử CuO. Khối lượng CuO bị khử là:
A. 15 gam
B. 45 gam
C. 60 gam
D. 30 gam
Đáp án D
nCu = 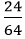
H2 + CuO 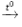
0,375 ← 0,375 (mol)
Khối lượng CuO bị khử là:
mCuO = nCuO.MCuO = 0,375.(64+16) = 30 gam
Câu 8: Cho khí H2 tác dụng với Fe2O3 nung nóng thu được 11,2g Fe. Thể tích khí H2 (đktc) đã tham gia phản ứng là:
A. 1,12lít
B. 2,24 lít
C. 6,72 lít
D. 4,48 lít
Đáp án C
nFe = 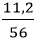
3H2 + Fe2O3 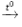
0,3 ← 0,2 (mol)
Thể tích khí H2 đã tham gia phản ứng là:
VH2 = 22,4.nH2 = 22,4.0,3 = 6,72 lít
Câu 9: Khử 48 gam đồng (II) oxit bằng khí hiđro cho 36,48 gam đồng. Hiệu suất của phản ứng là:
A. 90%
B. 95%
C. 94%
D. 85%
Đáp án B
nCuO = 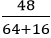
H2 + CuO 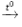
0,6 → 0,6 (mol)
Khối lượng đồng kim loại thu được theo lý thuyết là:
mCu lt = nCu.MCu = 0,6.64 = 38,4 gam
Hiệu suất của phản ứng là: H = 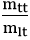
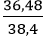
Câu 10: Khử hoàn toàn 12 gam sắt (III) oxit bằng khí hiđro. Thể tích khí hiđro (đktc) cần dùng là:
A. 5,04 lít
B. 7,56 lít
C. 10,08 lít
D. 8,2 lít
Đáp án A
nFe2O3 = 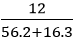
3H2 + Fe2O3 
0,225 ← 0,075 (mol)
Thể tích khí H2 cần dùng là:
VH2 = 22,4.nH2 = 22,4.0,225 = 5,04 lít

