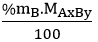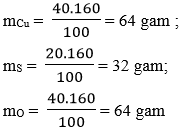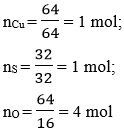Bài tập xác định công thức hóa học và gọi tên muối cực hay, chi tiết
Bài tập xác định công thức hóa học và gọi tên muối cực hay, chi tiết
Haylamdo biên soạn và sưu tầm Bài tập xác định công thức hóa học và gọi tên muối cực hay, chi tiết môn Hoá học lớp 8 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập từ đó đạt điểm cao trong bài thi môn Hoá 8.

A. Lý thuyết & Phương pháp giải
Một số kiến thức cần nắm vững về muối:
1. Khái niệm
- Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
- Ví dụ: NaCl, CuSO4, CaCO3, NaNO3,...
2. Công thức hóa học
- Thành phần phân tử: một hay nhiều nguyên tử kim loại và một hay nhiều gốc axit.
- Công thức hóa học dạng: MxAy
Trong đó: - M : là nguyên tử kim loại.
- A : là gốc axit.
Ví dụ: Na2CO3 NaHCO3
Gốc axit : =CO3 - HCO3
3. Tên gọi
- Tên muối = Tên KL + hoá trị (nếu KL có nhiều hoá trị) + tên gốc axit
Ví dụ:
Na2SO4: Natri sunfat
Na2SO3: Natri sunfit
- Tên gốc axit:
+ Gốc axit tương ứng với axit không có oxi: Tên gốc = tên phi kim + ua
+ Gốc axit tương ứng với axit có nhiều oxi: Tên gốc = tên phi kim + at
+ Gốc axit tương ứng với axit có ít oxi: Tên gốc = tên phi kim + it
Xác định công thức hoá học của muối khi biết thành phần các nguyên tố
Gọi công thức tổng quát của hợp chất là AxBy
Bước 1: Tìm khối lượng mỗi nguyên tố có trong 1 mol hợp chất.
mA = 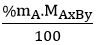
Bước 2: Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất.
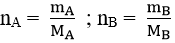
Bước 3: Lập công thức hóa học của hợp chất.
B. Ví dụ minh họa
Ví dụ 1: Viết công thức hóa học của những muối có tên gọi sau: Sắt (III) sunfat, Magie hiđrocacbonat, Kẽm sunfat, Đồng (II) clorua
Lời giải
Sắt (III) sunfat: Fe2(SO4)3
Magie hiđrocacbonat: Mg(HCO3)2
Kẽm sunfat: ZnSO4
Đồng (II) clorua: CuCl2
Ví dụ 2: Cho các sơ đồ phản ứng sau:
NaOH + HCl → NaCl + H2O
Al(OH)3+ H2SO4 → Al2(SO4) + H2O
a) Lập phương trình hóa học của phản ứng có sơ đồ trên
b) Gọi tên các muối tạo thành
Lời giải
a) Phương trình hóa học:
NaOH + HCl → NaCl + H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
b) Gọi tên các muối tạo thành:
NaCl: Natri clorua
Al2(SO4)3: Nhôm sunfat
Ví dụ 3: Muối A chứa Ca, C và O. Biết thành phần phần trăm về khối lượng của các nguyên tố Ca, C, O lần lượt là: 40%, 12%, 48%. Xác định công thức hóa học của A biết khối lượng mol của hợp chất là: 100 g/mol
Lời giải
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCa = 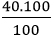
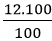
mO = 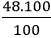
- Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là:
nCa = 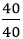
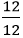
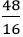
Vậy công thức hoá học của hợp chất là: CaCO3 (Canxi cacbonat)
C. Bài tập vận dụng
Câu 1: Công thức hóa học của muối bạc clorua là:
A. AgCl2
B. Ag2Cl
C. Ag2Cl3
D. AgCl
Đáp án D
Tên muối = Tên KL (kèm theo hoá trị nếu KL có nhiều hoá trị) + tên gốc axit
⇒ Công thức hóa học của bạc clorua là AgCl
Câu 2: Công thức hóa học của muối nhôm clorua là:
A. AlCl.
B. Al3Cl.
C. AlCl3.
D. Al3Cl2.
Đáp án C
Tên muối = Tên KL (kèm theo hoá trị nếu KL có nhiều hoá trị) + tên gốc axit
⇒ Công thức hóa học của muối nhôm clorua là AlCl3
Câu 3: Hợp chất Na2SO4 có tên gọi là:
A. natri sunfat.
B. natri sunfit.
C. sunfat natri.
D. natri sunfuric.
Đáp án A
Tên muối = Tên KL (kèm theo hoá trị nếu KL có nhiều hoá trị) + tên gốc axit
⇒ tên gọi của Na2SO4 là: Natri sunfat
Câu 4: Hợp chất nào sau đây không phải là muối?
A. Đồng (II) nitrat
B. Kali clorua
C. Sắt (II) sunfat
D. Canxi hiđroxit
Đáp án D
Muối = kim loại + gốc axit
Hợp chất không phải muối là: Canxi hiđroxit vì canxi hiđroxit thuộc loại bazơ
Câu 5: Cho các chất sau: CaO, H2SO4, Fe(OH)2, FeSO4, CaSO4, HCl, LiOH, MnO2, CuCl2, Al(OH)3, SO2. Có bao nhiêu hợp chất là muối?
A. 3
B. 4
C. 5
D. 6
Đáp án A
Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit ⇒ Các muối là: FeSO4, CaSO4, CuCl2
Câu 6: Cho phương trình sau: Zn +H2SO4 → ZnSO4 +H2↑. Tên gọi của muối thu được là:
A. Kẽm (II) sunfat
B. Kẽm sunfat
C. Kẽm (II) sunfit
D. Sunfat kẽm
Đáp án B
Tên muối = Tên KL (kèm theo hoá trị nếu KL có nhiều hoá trị) + tên gốc axit
⇒ tên gọi của ZnSO4 là: Kẽm sunfat.
Câu 7: Dãy chất nào sau đây chỉ bao gồm muối:
A. MgCl2; Na2SO4; KNO3
B. Na2CO3; H2SO4; Ba(OH)2
C. CaSO4; HCl; MgCO3
D. H2O; Na3PO4; KOH
Đáp án A
Dãy chất chỉ toàn bao gồm muối là: MgCl2; Na2SO4; KNO3
Loại B vì H2SO4 là axit, Ba(OH)2 là bazơ
Loại C vì HCl là axit
Loại D vì H2O không phải muối, KOH là bazơ
Câu 8: Một hợp chất gồm 2 nguyên tố kết hợp với nhau theo tỉ lệ khối lượng là 3 phần magie với 4 phần lưu huỳnh. Tìm công thức hóa học đơn giản của hợp chất đó?
A. MgS.
B. Mg2S.
C. MgS2.
D. Mg2S2
Đáp án A
Giả sử phần Mg có khối lượng 3 gam → phần lưu huỳnh có khối lượng 4 gam.
Số mol Mg kết hợp với lưu huỳnh: nMg = 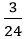
Số mol S kết hợp với magie: nS = 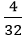
Vậy 0,125 mol nguyên tử Mg kết hợp với 0,125 mol nguyên tử S
Nên công thức hóa học đơn giản của hợp chất là MgS (Magie sunfua)
Câu 9: Một hơp chất có thành phần các nguyên tố là 40% Cu; 20% S và 40% O. Hãy xác định công thức hoá học của hợp chất (biết khối lượng mol của hợp chất là 160 g/mol)
A. CuSO3
B. CuSO4
C. Cu2SO4
D. Cu2(SO4)3
Đáp án B
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
- Số mol nguyên tử của mỗi nguyên tố trong một mol hợp chất là:
Vậy công thức hoá học của hợp chất là: CuSO4
Câu 10: Hợp chất A có khối lượng mol 58,5 g/mol, thành phần phần trăm theo khối lượng của các nguyên tố là: 60,68% Cl, còn lại là Na. Công thức hóa học của hợp chất là:
A. NaCl
B. NaCl2
C. Na2Cl
D. Na2Cl2
Đáp án A
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mCl = 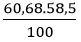
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nCl = 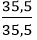
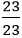
Vậy công thức hoá học của hợp chất là NaCl (Natri clorua)