Lý thuyết KHTN 9 Bài 16: Tính chất chung của kim loại - Chân trời sáng tạo
Haylamdo biên soạn tóm tắt lý thuyết Khoa học tự nhiên 9 Bài 16: Tính chất chung của kim loại sách Chân trời sáng tạo hay nhất, ngắn gọn sẽ giúp học sinh lớp 9 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 9.
Lý thuyết KHTN 9 Bài 16: Tính chất chung của kim loại - Chân trời sáng tạo
1. Tính chất vật lí của kim loại
Tính chất vật lí của kim loại như sau:
- Kim loại có tính dẻo:
+ Nhờ có tính dẻo, kim loại có thể dát mỏng, kéo thành sợi,… tạo nên các đồ vật khác nhau.
+ Các kim loại khác nhau thường có độ dẻo khác nhau.
+ Những kim loại có độ dẻo cao là Au, Ag, Al, Cu,…
- Một số kim loại được sử dụng làm dây dẫn điện phục vụ đời sống nhờ có tính dẫn điện.
+ Các kim loại khác nhau có khả năng dẫn điện khác nhau.
+ Những kim loại dẫn điện tốt là Ag, Cu, Au, Al,…
- Con người đã ứng dụng tính dẫn nhiệt của kim loại để phục vụ đời sống và sản xuất.
+ Ví dụ: nhôm có tính dẫn nhiệt tố và một số tính chất khác nên được dùng làm dụng cụ đun nấu (xoong, nồi, chảo,…).
+ Các kim loại khác nhau có khả năng dẫn nhiệt khác nhau, kim loại nào dẫn điện tốt thường cũng dẫn nhiệt tốt.
- Kim loại có ánh kim:
+ Ánh kim: quan sát bề mặt các kim loại như vàng, bạc, chromium,… ta thấy chúng có bề mặt sáng lấp lánh.
+ Các kim loại khác như đồng (copper, Cu), sắt (iron, Fe), thuỷ ngân (mercury, Hg),… cũng có vẻ sáng tương tự.
- Những kim loại khác nhau có nhiệt độ nóng chảy và khối lượng riêng khác nhau.
Ví dụ:
+ Kim loại có nhiệt độ nóng chảy thấp như thuỷ ngân -390C.
+ Kim loại có nhiệt độ nóng chảy cao như tungsten (W) 34100C.
2. Tính chất hoá học cơ bản của kim loại
Một số tính chất hoá học cơ bản của kim loại:
a) Kim loại phản ứng với oxygen tạo thành oxide
Nhiều kim loại (trừ Au,…) phản ứng với oxygen tạo thành oxide kim loại (thường là oxide base).
Ví dụ:
b) Kim loại phản ứng với các phi kim khác tạo thành muối
- Nhiều kim loại phản ứng với lưu huỳnh tạo thành muối sulfide.
Ví dụ:
- Hầu hết kim loại phản ứng với khí chlorine tạo thành muối chloride.
Ví dụ:
c) Một số kim loại phản ứng với nước
- Các kim loại nhóm IA và IIA trong bảng tuần hoàn các nguyên tố hoá học (trừ Be, Mg) phản ứng với nước ở nhiệt độ thường tạo hydroxide và khí hydrogen.
- Ví dụ: 2Na + 2H2O → 2NaOH + H2↑
- Một số kim loại như Mg, Zn, Fe,… khi phản ứng với hơi nước ở nhiệt độ cao tạo thành oxide và hydrogen.
- Ví dụ:
d) Một số kim loại phản ứng với dung dịch hydrochloric acid
- Nhiều kim loại (trừ Cu, Hg, Ag, Pt, Au,…) phản ứng với dung dịch hydrochloric acid tạo thành muối chloride và khí hydrogen.
- Ví dụ: Zn + 2HCl → ZnCl2 + H2↑
e) Một số kim loại phản ứng với dung dịch muối
- Nhiều kim loại (không tan trong nước) phản ứng được với các dung dịch muối (như CuSO4, AgNO3,…) tạo thành muối mới và kim loại mới.
- Ví dụ: Zn + CuSO4 → ZnSO4 + Cu
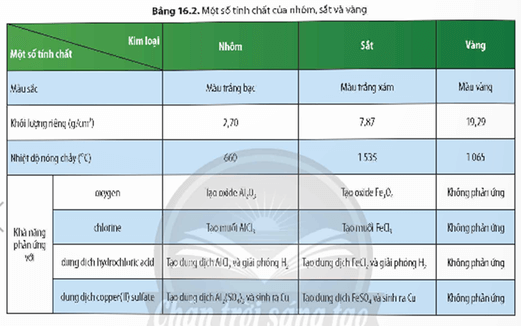
3. Một số khác biệt về tính chất giữa các kim loại thông dụng
- Các kim loại khác nhau sẽ có một số tính chất riêng biệt.