Lý thuyết KHTN 9 Bài 19: Sự khác nhau cơ bản giữa phi kim và kim loại - Chân trời sáng tạo
Haylamdo biên soạn tóm tắt lý thuyết Khoa học tự nhiên 9 Bài 19: Sự khác nhau cơ bản giữa phi kim và kim loại sách Chân trời sáng tạo hay nhất, ngắn gọn sẽ giúp học sinh lớp 9 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 9.
Lý thuyết KHTN 9 Bài 19: Sự khác nhau cơ bản giữa phi kim và kim loại - Chân trời sáng tạo
1. Ứng dụng của một số đơn chất phi kim
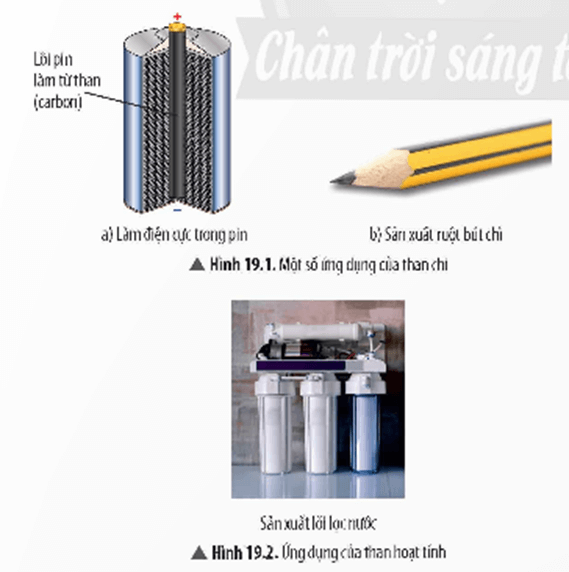
a. Ứng dụng của carbon
- Than (thành phần chính là carbon) là một trong những nguồn nhiên liệu cung cấp năng lượng cho hoạt động công nghiệp và đời sống của con người.
- Ngoài ra, carbon dùng làm điện cực, ruột bút chì, lõi lọc nước,…
b. Ứng dụng của lưu huỳnh (sulfur)
Lưu huỳnh dùng làm nguyên liệu sản xuất sulfuric acid, lưu hoá cao su,…
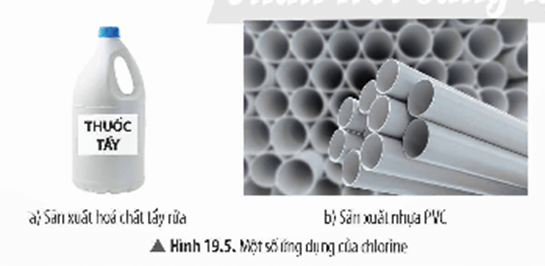
c. Ứng dụng của chlorine
Cholorine dùng để sản xuất hoá chất tẩy rửa, nhựa PVC,…
2. Sự khác nhau về một số tính chất giữa phi kim và kim loại
Các nguyên tố kim loại và phi kim có sự khác nhau ở một số tính chất (vật lí và hoá học). Dựa vào những tính chất khác biệt đó, người ta sẽ nghiên cứu, chế tạo thiết bị, vật dụng phù hợp để đáp ứng với nhu cầu cuộc sống, sản xuất.
* Sự khác nhau về tính chất vật lí
Kim loại |
Phi kim |
|
Tính dẫn điện, dẫn nhiệt |
- Dẫn điện, dẫn nhiệt tốt. |
- Thường không dẫn điện, dẫn nhiệt kém. |
Nhiệt độ nóng chảy, nhiệt độ sôi |
- Thường có nhiệt độ nóng chảy, nhiệt độ sôi cao. - Kim loại hầu hết ở trạng thái rắn (trừ thủy ngân ở trạng thái lỏng). |
- Thường có nhiệt độ nóng chảy, nhiệt độ sôi thấp. - Ở điều kiện thường phi kim tồn tại ở cả ba thể: rắn (C, S, …), lỏng (Br2), khí (Cl2, O2, …). |
Khối lượng riêng |
- Có khối lượng riêng lớn. |
- Có khối lượng riêng nhỏ. |
*Sự khác nhau về tính chất hóa học
Kim loại |
Phi kim |
|
Khả năng tạo ion |
- Có xu hướng nhường electron để tạo thành ion dương khi tham gia các phản ứng hóa học. VD: Na → Na+ + 1e Mg → Mg2+ + 2e Al → Al3+ + 3e |
- Có xu hướng nhận electron để tạo thành ion âm khi tham gia các phản ứng hóa học. VD: Cl + 1e → Cl- S + 2e → S2- N + 3e → N3- |
Phản ứng với oxygen |
- Kim loại phản ứng với oxygen thường tạo thành oxide base. VD: 2Mg + O2 2MgO 3Fe + 2O2 Fe3O4 |
- Phi kim phản ứng với oxygen thường tạo thành oxide acid. VD: C + O2 CO2 S + O2 SO2 |