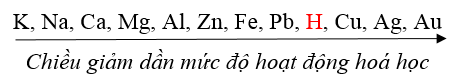Lý thuyết KHTN 9 Bài 16: Dãy hoạt động hoá học - Cánh diều
Haylamdo biên soạn tóm tắt lý thuyết Khoa học tự nhiên 9 Bài 16: Dãy hoạt động hoá học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh lớp 9 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 9.
Lý thuyết KHTN 9 Bài 16: Dãy hoạt động hoá học - Cánh diều
I. XÂY DỰNG DÃY HOẠT ĐỘNG HOÁ HỌC
- Dựa vào khả năng và mức độ phản ứng của các kim loại với một số chất, ta có thể so sánh được mức độ hoạt động hoá học của chúng với nhau.
- Để so sánh mức độ hoạt động hoá học khi cho kim loại tiếp xúc với nước, hydrochloric acid,… người ta tiến hành một số thí nghiệm sau:
+ Thí nghiệm 1: Dung dịch AgNO3 và đồng rút ra đồng có mức độ hoạt động hoá học mạnh hơn bạc.
+ Thí nghiệm 2: Dung dịch HCl với từng kim loại magnesium, sắt, đồng thì xếp được dãy giảm dần mức độ hoạt động hoá học của kim loại và hydrogen: Mg, Fe, H, Cu.
+ Thí nghiệm 3: Nước với từng kim loại natri, magnesium rút ra natri có mức độ hoạt động hoá học mạnh hơn magnesium.
- Từ kết quả trên và kết quả của một số thí nghiệm khác, người ta đã thiết lập được dãy hoạt động hoá học sau:
II. Ý NGHĨA CỦA DÃY HOẠT ĐỘNG HOÁ HỌC
Dãy hoạt động hoá học cho biết:
- Mức độ hoạt động hoá học của kim loại giảm dần từ trái sang phải.
- Các kim loại đứng trước H tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
Ví dụ:
Mg + 2HCl → MgCl2 + H2
- Các kim loại đứng trước Mg phản ứng mạnh với nước ở điều kiện thường, giải phóng khí hydrogen.
Ví dụ:
2Na + 2H2O → 2NaOH + H2
- Kim loại đứng trước (trừ K, Na,…) đẩy được kim loại đứng sau ra khỏi dung dịch muối.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu