Lý thuyết KHTN 9 Bài 17: Tách kim loại. Sử dụng hợp kim - Cánh diều
Haylamdo biên soạn tóm tắt lý thuyết Khoa học tự nhiên 9 Bài 17: Tách kim loại. Sử dụng hợp kim sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh lớp 9 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 9.
Lý thuyết KHTN 9 Bài 17: Tách kim loại. Sử dụng hợp kim - Cánh diều
I. PHƯƠNG PHÁP TÁCH KIM LOẠI
- Từ quặng, người ta thường làm giàu quặng bằng cách loại bỏ tạp chất (đất, cát, đá,…) để thu được hợp chất của kim loại có hàm lượng cao. Sau đó, từ hợp chất của kim loại sẽ tách được kim loại ở dạng đơn chất bằng phương pháp thích hợp như phương pháp điện phân nóng chảy, phương pháp nhiệt luyện và phương pháp thuỷ luyện.
1. Phương pháp điện phân nóng chảy
- Thường dùng để tách các kim loạicó mức độ hoạt động hoá học mạnh như Na, Mg, Al,…
Ví dụ: Từ quặng bauxite, tách được aluminium oxide (Al2O3). Điện phân nóng chảy Al2O3, tách được nhôm (aluminium – Al) ra khỏi oxide theo phương trình hoá học:
2. Phương pháp nhiệt luyện
- Thường được dùng để tách các kim loại có mức độ hoạt động hoá học trung bình và yếu như Fe, Zn, Cu…
- Ví dụ 1: Tách được sắt ra khỏi iron(III) oxide (Fe2O3):
- Ví dụ 2: Quặng sphalerite có thành phần chính là zinc sulfide (ZnS). Từ quặng sphalerite người ta tách kẽm như sau:
+ Nung quặng sphalerite trong không khí ở nhiệt độ cao thu được zinc oxide (ZnO):
+ Sau đó, cho zinc oxide phản ứng với carbon ở nhiệt độ cao, tách được kẽm:
3. Mở rộng về phương pháp thuỷ luyện
- Phương pháp thuỷ luyện để tách các kim loại có mức độ hoạt động hoá học yếu.
- Trước tiên, các đơn chất hoặc hợp chất của kim loại có mức độ hoạt động yếu có trong khoáng vật được chuyển thành muối tan. Sau đó dùng kim loại có mức độ hoạt động hoá học mạnh hơn để đẩy các kim loại có mức độ hoạt động hoá học yếu hơn ra khỏi dung dịch muối.
II. HỢP KIM
1. Khái niệm hợp kim
- Hợp kim là vật liệu kim loại có chứa kim loại cơ bản và kim loại khác hoặc phi kim.
- Ví dụ: Khi trộn đều, làm nguội hỗn hợp nóng chảy gồm nhôm và một lượng nhỏ đồng thu được hợp kim Al – Cu. Hợp kim này được gọi là hợp kim của nhôm do nhôm là kim loại cơ bản để tạo nên chúng.
2. Sử dụng hợp kim
- Một số hợp kim có nhiều tính chất ưu việt hơn so với kim loại tạo nên chúng, như tính cứng, độ bền cơ học, hoá học, khả năng chịu mài mòn,…
Ví dụ: Đồng thau (hợp kim của đồng và kẽm) cứng hơn, chịu ăn mòn tốt hơn đồng hoặc kẽm.
- Nhiều loại hợp kim của nhôm, của sắt, của đồng,… được sử dụng làm vật liệu xây dựng, vật liệu chế tạo máy móc, thiết bị, dụng cụ, đồ dùng,…
3. Một số hợp kim phổ biến
Hợp kim của sắt và hợp kim của nhôm được sử dụng phổ biến trong cuộc sống.
4. Sản xuất gang, thép
a. Sản xuất gang
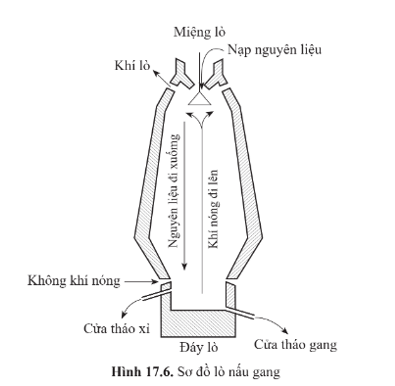
- Nguyên liệu: quặng sắt (thường là quặng hematite), than cốc và chất tạo xỉ như CaCO3, SiO2,… Các nguyên liệu này được xếp thành từng lớp xen kẽ và được cho di chuyển chậm từ miệng lò xuống đáy lò, tiếp xúc với luồng không khí nóng đi ngược từ phía dưới đáy lò lên.
- Các giai đoạn cơ bản của quá trình sản xuất gang bao gồm:
+ Than bị cháy trong lò tạo khí carbon monoxide theo các phản ứng sau:
+ CO phản ứng với oxide của sắt và một số oxide tạp chất có trong nguyên liệu tạo ra Fe cùng với Mn, Si,…
Sắt nóng chảy hoà tan một lượng nhỏ carbon cùng một số nguyên tố khác như Mn, Si,… tạo thành gang lỏng, chảy xuống đáy lò và sau đó được dẫn ra ngoài qua cửa tháo gang. Hàm lượng carbon trong gang vào khoảng 2 – 5%.
+ Trong quá trình nung, đá vôi bị phân huỷ tạo thành calcium oxide (CaO):
CaO kết hợp với các tạp chất trong quặng tạo thành xỉ như:
Xỉ nhẹ nên nổi lên trên bề mặt gang lỏng, được tháo ra ngoài qua cửa tháo xỉ.
b. Sản xuất thép
- Nguyên liệu chính: Gang hoặc thép phế liệu và khí oxygen.
- Quá trình sản xuất thép: Khí oxygen được sục vào lò chứa gang hoặc thép phế liệu hoặc hỗn hợp gồm gang và thép phế liệu nóng chảy. Khí oxygen phản ứng với một phần các nguyên tố C, P, Si, Mn,… có trong nguyên liệu nóng chảy tạo thành một số hợp chất ở thế khí tự thoát ra khỏi lò và một số chất ở dạng xỉ được tháo ra khỏi lò. Sản phẩm còn lại trong lò là thép với thành phần chính là sắt và carbon, trong đó, hàm lượng của carbon nhỏ hơn 2%. Thép nóng chảy được chuyển sang khu vực đổ khuôn tạo hình và làm nguội.