Tính chất của Sắt oxit FeO - Tính chất hoá học, tính chất vật lí, điều chế, ứng dụng
Tính chất của Sắt oxit FeO
I. Định nghĩa
- Định nghĩa: Sắt (II) oxit là hợp chất tạo bởi một nguyên tố Fe và một nguyên tử oxi.
- Công thức phân tử: FeO.
- Công thức cấu tạo: Fe=O
II. Tính chất vật lí
- Là chất rắn, màu đen, không tan trong nước.
III. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của oxit bazo.
- Là chất vừa có tính oxi hóa, vừa có tính khử
1. Tính oxit bazơ
FeO tác dụng với dung dịch axit: HCl, H2SO2 loãng
FeO + 2HCl → FeCl2 + H2
FeO + H2SO4 loãng → FeSO4 + H2O
2. Tính oxi hóa
- Tác dụng với chất khử như H2, CO, Al, C…
FeO + H2 → Fe + H2O
FeO + CO → Fe + CO2
3FeO + 2Al → Al2O3 + 3Fe
3. Tính khử
- FeO là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3FeO + 10HNO3 loãng → 3Fe(NO3)3 + NO + 5H2O
2FeO + 4H2SO4 (đặc) → Fe2(SO4)3 + SO2 + 4H2O
IV. Điều chế
- Nhiệt phân Fe(OH)2 trong môi trường không có không khí
Fe(OH)2 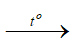
- Nung FeCO3 trong điều kiện không có không khí
FeCO3 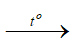

V. Ứng dụng
- FeO được xúc tác với Fe2O3 tạo ra Fe3O4:
Fe2O3 + FeO 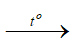
Trong công nghiệp, FeO là hợp chất quan trọng để tác dụng với chất khử mạnh sản xuất ra sắt:
FeO + H2 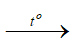
FeO + CO 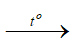
2Al + 3 FeO 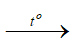
- FeO trong vật liệu gốm có thể được hình thành bởi phản ứng khử sắt(III) oxit trong lò nung. Khi sắt ba đã bị khử thành sắt hai trong men thì rất khó oxy hoá trở lại. Hầu hết các loại men sẽ có độ hoà tan sắt hai khi nung chảy cao hơn khi ở trạng thái rắn do đó sẽ có sắt oxit kết tinh trong men khi làm nguội, môi trường oxy hoá hay khử.

