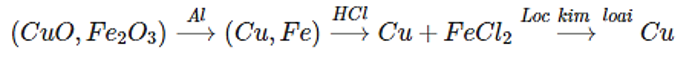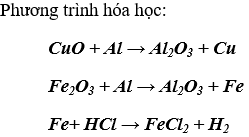Giải vở bài tập Hóa Học 9 Bài 16: Tính chất hóa học của kim loại
Giải vở bài tập Hóa Học 9 Bài 16: Tính chất hóa học của kim loại
Nhằm mục đích giúp học sinh dễ dàng làm bài tập về nhà trong Vở bài tập Hóa Học lớp 9, chúng tôi biên soạn giải vở bài tập Hóa Học lớp 9 Bài 16: Tính chất hóa học của kim loại hay nhất, ngắn gọn bám sát nội dung sách Vở bài tập Hóa Học 9.
Học theo Sách giáo khoa
I. PHẢN ỨNG CỦA KIM LOẠI VỚI PHI KIM
1. Hầu hết kim loại (trừ Au, Pt, Ag,...) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
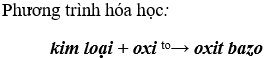
2. Ở nhiệt độ cao, nhiều kim loại tác dụng với nhiều phi kim khác (Cl., S,...) tạo thành muối.
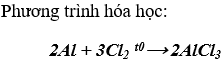
II. PHẢN ỨNG CỦA KIM LOẠI VỚI DUNG DỊCH AXIT
Một số kim loại tác dụng với dung dịch axit tạo thành muối và H2
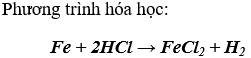
III. PHẢN ỨNG CỦA KIM LOẠI VỚI DUNG DỊCH MUỐI
1. Phản ứng của đồng với dung dịch bạc nitrat
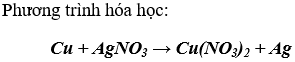
2. Phản ứng của kẽm với dung dịch đồng (II) sunfat
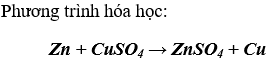
Nhận xét: Kim loại hoạt dộng mạnh hơn (trừ Na, K, Ba,...) tác dụng với muối của kim loại yếu hơn, tạo thành muối và kim loại mới.
Bài tập
Bài 1. (Trang 46 Vở Bài Tập Hóa học 9 ) Kim loại có những tính chất hoá học nào ? Lấy thí dụ và viết các phương trinh hoá học minh hoạ với kim loại magie.
Lời giải:
Kim loại có các tính chất hóa học là:

Bài 2. (Trang 46 Vở Bài Tập Hóa học 9 ) Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây :
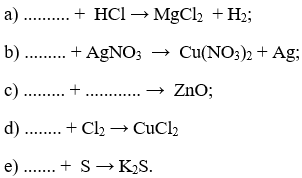
Lời giải:
Hoàn thành các phương trình hóa học:
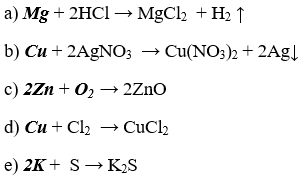
Bài 3. (Trang 46 Vở Bài Tập Hóa học 9 ) Viết các phương trình hoá học của các phản ứng xảy ra giữa các cặp chất sau đây:
a) Kẽm + Axit sunturic loãng ;
b) Kẽm + Dung dịch bạc nitrat;
c) Natri + Lưu huỳnh ;
d) Canxi + Clo.
Lời giải:
Viết các phương trình hóa học xảy ra:
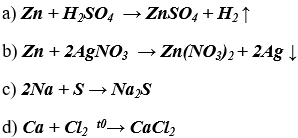
Bài 4. (Trang 47 Vở Bài Tập Hóa học 9 ) Dựa vào tính chất hoá học của kim loại, hãy viết các phương trình hoá học biểu diễn các chuyển đổi sau đây:
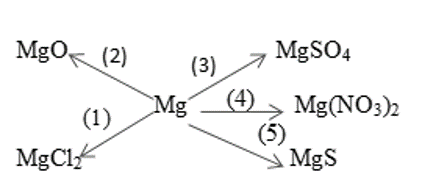
Lời giải:
Dựa vào tính chất hóa học của kim loại, viết các phương trình hóa học biểu diễn chuyển đổi:
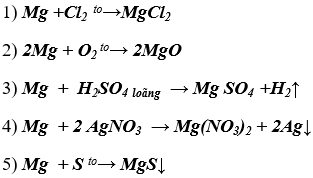
Bài 5. (Trang 47 Vở Bài Tập Hóa học 9 ) Dự đoán hiện tượng và viết phương trình hoá học khi:
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuSO4.
Lời giải:
Dự đoán hiện tượng hóa học và viết phương trình hóa học của phản ứng xảy ra khi:
a) Sắt bị nóng chảy, thu được FeCl3 có màu đỏ nâu
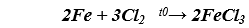
b) Thanh sắt tan dần, có kim loại màu đỏ sinh ra bám vào đinh sắt đồng thời dung dịch màu xanh lam nhạt màu dần.
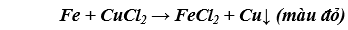
c) Viên kẽm tan dần đến hết, CuSO4 nhạt màu, xuất hiện kim loại màu đỏ
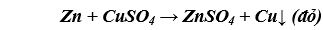
Bài 6. (Trang 47 Vở Bài Tập Hóa học 9 ) Ngâm một lá kẽm trong 20 g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Lời giải:
Số mol đồng sunfat đã dùng 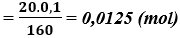
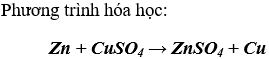
Theo phương trình
- số mol kẽm phản ứng = 0,0125 mol hay 0,8125 gam
- số mol muối tạo ra = 0,0125 mol hay 2,0125 gam
Khối lượng dung dịch sau phản ứng 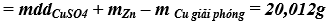
Nồng độ phần trăm của dung dịch sau phản ứng 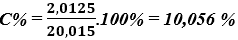
Bài 7. (Trang 47 Vở Bài Tập Hóa học 9 ) Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nổng độ mol của dung dịch bạc nitrat đã dùng
Lời giải:
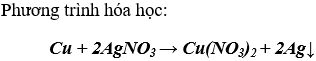
Theo phương trình:
1 mol Cu tác dụng với 2 mol AgNO3 thì khối lượng tăng 152 gam
0,5x mol Cu tác dụng với x mol AgNO3 thì khối lượng tăng 1,52 gam
Suy ra: x = 0,02 (mol) (AgNO3)
Nồng độ dung dịch AgNO3: 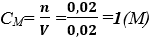
Bài tập bổ sung
Bài 1. (Trang 48 Vở Bài Tập Hóa học 9 ) Cho các kim loại: Fe, Cu, Ag, Al, Mg. Đánh đấu x vào ô Đ nếu kết luận đúng và ô S nếu kết luận sai:

Lời giải:

Bài 2. (Trang 48 Vở Bài Tập Hóa học 9 ) Hỗn hợp gồm CuO, Fe2O3. Chỉ dùng Al và dung dịch HCl, hãy nêu phương pháp điều chế Cu nguyên chất (dùng sơ đồ).
Lời giải:
Sơ đồ: