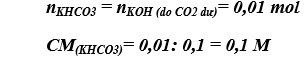Giải vở bài tập Hóa Học 9 Bài 28: Các oxit của cacbon
Giải vở bài tập Hóa Học 9 Bài 28: Các oxit của cacbon
Nhằm mục đích giúp học sinh dễ dàng làm bài tập về nhà trong Vở bài tập Hóa Học lớp 9, chúng tôi biên soạn giải vở bài tập Hóa Học lớp 9 Bài 28: Các oxit của cacbon hay nhất, ngắn gọn bám sát nội dung sách Vở bài tập Hóa Học 9.
Học theo Sách giáo khoa
I. CACBON OXIT (CO)
1. Tính chất vật lí
CO là chất khí, không màu, không mùi, hơi nhẹ hơn không khí, rất độc, ít tan trong nước.
2. Tính chất hóa học
a) CO là oxit trung tính: ở điều kiện thường không phản ứng với nước, kiềm và axit.
b) CO là chất khử: ở nhiệt độ cao cacbon oxit khử được nhiều ốxit kim loại ở nhiệt độ cao và cháy trong oxi
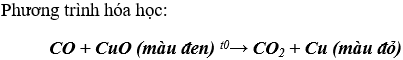
CO cháy trong oxi, ngọn lửa màu anh, tỏa nhiều nhiệt
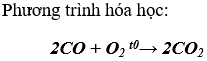
3. Ứng dụng: dùng làm nhiên liệu, chất khử.. .Ngoài ra còn được dùng làm nguyên liệu trong công nghiệp hóa học.
II. CACBON ĐIOXIT (CO2)
1. Tính chất vật lí
CO2 là chất khí, không màu, không mùi, nặng hơn không khí, không duy trì sự sống và sự cháy. Nước đá khô (tuyết cacbonic ) là CO2 bị nén và làm lạnh thì hóa rắn dùng bảo quản thực phẩm.
2. Tính chất hóa học: CO2 là một oxit axit.
a) Tác dụng với nước tạo thành axit cacbonic:
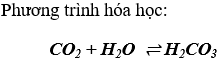
b) Tác dụng với dd bazơ tan tạo thành muối và nước:
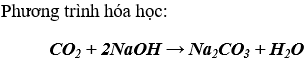
c) Tác dụng với oxit bazơ tan tạo thành muối:
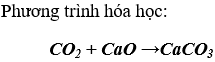
Kết luận: CO2 có những tính chất của oxit axit.
3. Ứng dụng: CO2 dùng để chữa cháy, bảo quản thực phẩm. CO2 còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,...
Bài tập
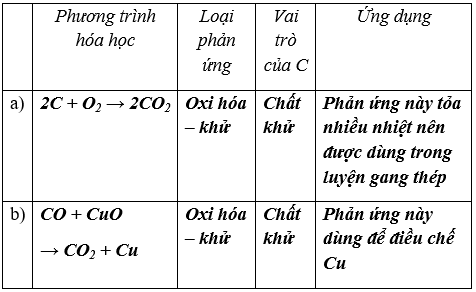
Bài 1. (Trang 83 Vở Bài Tập Hóa học 9 ) Hãy viết phương trình hoá học của CO với:
a) khí O2 ;
b) CuO.
Cho biết: loại phản ứng ; điều kiện phản ứng ; vai trò của CO và ứng dụng của mỗi phản ứng đó.
Lời giải:
Bài 2. (Trang 83 Vở Bài Tập Hóa học 9 ) Hãy viết phương trình hoá học của CO2 với dung dịch NaOH, dung dịch Ca(OH)2 trừơng trường hợp:
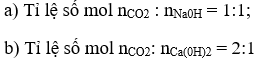
Lời giải:

Bài 3. (Trang 83 Vở Bài Tập Hóa học 9 ) Có hỗn hợp hai khí CO và CO2. Nêu phương pháp hoá học để chứng minh sự có mặt của hai khí đó. Viết các phương trình hoá học.
Lời giải:
Chứng minh sự có mặt của CO2 và CO bằng cách: dùng nước vôi trong và CuO
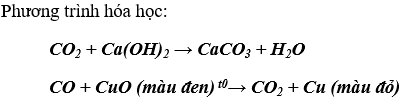
Bài 4. (Trang 84 Vở Bài Tập Hóa học 9 ) Trên bề mặt các hố nước tôi vôi lâu ngày thường có lớp màng chất rắn. Hãy giải thích hiện tượng này và viết phương trình hoá học.
Lời giải:
Màng rắn đó là: CaCO3 vì trong nước tôi vôi có chứa nước vôi trong và trong không khí có khí CO2 nên xảy ra phản ứng tạo kết tủa CaCO3
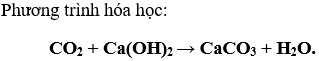
Bài 5. (Trang 84 Vở Bài Tập Hóa học 9 ) Hãy xác định thành phần % về thể tích của mỗi khí trong hỗn hợp CO và CO2, biết các số liệu thực nghiệm sau :
- Dẫn 16 lít hỗn hợp CO và CO2 qua nước vôi trong dư thu được khí A.
- Để đốt cháy hoàn toàn khí A cần 2 lít khí oxi.
Các thể tích khí được đo ở cùng điểu kiện nhiệt độ và áp suất.
Lời giải:
Khí A là khí CO vì CO không phản ứng với nước vôi trong dư
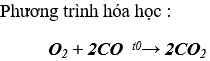
Theo phương trình, thể tích khí CO là V(CO) = 4 lít
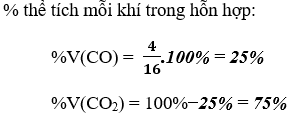
Bài tập bổ sung
Bài 1. (Trang 84 Vở Bài Tập Hóa học 9 ) Không nên ủ lò than trong phòng kín. Hãy giải thích và viết phương trình hóa học.
Lời giải:
Không nên ủ lò than trong phòng kín vì Than cháy trong điều kiện thiếu không khí sẽ tạo ra một loại khí cực độc là CO
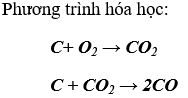
Bài 2. (Trang 84 Vở Bài Tập Hóa học 9 ) Hãy ghép một chữ A, B, C, D với số 1, 2, 3, 4 hoặc 5 cho phù hợp
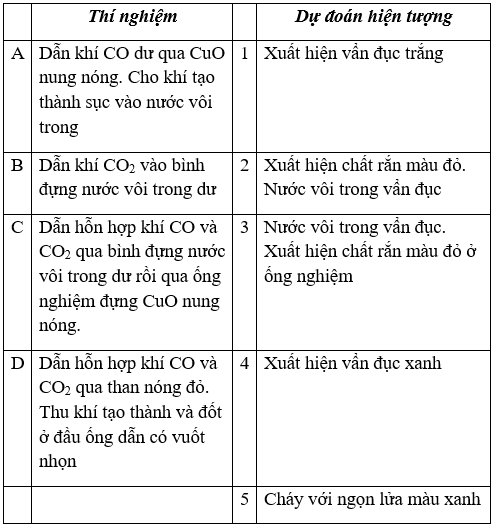
Lời giải:
Đáp án: A – 2 ; B – 1 ; C – 3 ; D – 5
Bài 2. (Trang 84 Vở Bài Tập Hóa học 9 ) Dẫn 0,336 lít khí CO2 (đktc) vào bình đựng 100ml dung dịch KOH 0,1M
a) Sản phẩm thu được sau phản ứng là:
A. KHCO3
B. K2CO3
C. K2CO3 và KOH
D. KHCO3 và K2CO3
Hãy giải thích và viết phương trình hóa học, nếu có.
b) Tính nồng độ mol của các chất trong dung dịch sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể và khí CO2 hòa tan vào nước không đáng kể.
Lời giải:
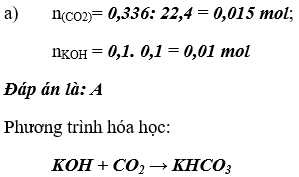
b) Nồng độ mol của các chất trong dung dịch sau phản ứng: