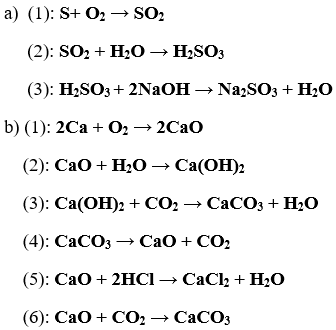Vở bài tập Hóa Học lớp 9 - Giải vở bài tập Hóa Học 9 hay, ngắn nhất
Vở bài tập Hóa Học lớp 9 - Giải vở bài tập Hóa Học 9 hay, ngắn nhất
Tuyển tập các bài giải vở bài tập Hóa Học lớp 9 hay, ngắn nhất, chi tiết được biên soạn bám sát nội dung sách Vở bài tập Hóa Học 9 giúp bạn củng cố kiến thức, biết cách làm bài tập môn Hóa Học lớp 9.
Chương 1: Các loại hợp chất vô cơ
- Vở bài tập Hóa 9 Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Vở bài tập Hóa 9 Bài 2: Một số oxit quan trọng: Canxi Oxit
- Vở bài tập Hóa 9 Bài 2: Một số oxit quan trọng: Lưu huỳnh Đioxit
- Vở bài tập Hóa 9 Bài 3: Tính chất hóa học của axit
- Vở bài tập Hóa 9 Bài 4: Một số axit quan trọng
- Vở bài tập Hóa 9 Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
- Vở bài tập Hóa 9 Bài 7: Tính chất hóa học của bazơ
- Vở bài tập Hóa 9 Bài 8: Một số bazơ quan trọng: Natri Hidroxit (NaOH)
- Vở bài tập Hóa 9 Bài 8: Một số bazơ quan trọng: Canxi Hidroxit ( Ca(OH)2 )- Thang pH
- Vở bài tập Hóa 9 Bài 9: Tính chất hóa học của muối
- Vở bài tập Hóa 9 Bài 10: Một số muối quan trọng
- Vở bài tập Hóa 9 Bài 11: Phân bón hóa học
- Vở bài tập Hóa 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
- Vở bài tập Hóa 9 Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ
Chương 2: Kim loại
- Vở bài tập Hóa 9 Bài 15: Tính chất vật lí của kim loại
- Vở bài tập Hóa 9 Bài 16: Tính chất hóa học của kim loại
- Vở bài tập Hóa 9 Bài 17: Dãy hoạt động hóa học của kim loại
- Vở bài tập Hóa 9 Bài 18: Nhôm
- Vở bài tập Hóa 9 Bài 19: Sắt
- Vở bài tập Hóa 9 Bài 20: Hợp kim sắt: Gang, thép
- Vở bài tập Hóa 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Vở bài tập Hóa 9 Bài 22: Luyện tập chương 2: Kim loại
- Vở bài tập Hóa 9 Bài 24: Ôn tập học kì 1
Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Vở bài tập Hóa 9 Bài 25: Tính chất của phi kim
- Vở bài tập Hóa 9 Bài 26: Clo
- Vở bài tập Hóa 9 Bài 27: Cacbon
- Vở bài tập Hóa 9 Bài 28: Các oxit của cacbon
- Vở bài tập Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
- Vở bài tập Hóa 9 Bài 30: Silic. Công nghiệp silicat
- Vở bài tập Hóa 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Vở bài tập Hóa 9 Bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Chương 4: Hiđrocacbon. Nhiên liệu
- Vở bài tập Hóa 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Vở bài tập Hóa 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- Vở bài tập Hóa 9 Bài 36: Metan
- Vở bài tập Hóa 9 Bài 37: Etilen
- Vở bài tập Hóa 9 Bài 38: Axetilen
- Vở bài tập Hóa 9 Bài 39: Benzen
- Vở bài tập Hóa 9 Bài 40: Dầu mỏ và khí thiên nhiên
- Vở bài tập Hóa 9 Bài 41: Nhiên liệu
- Vở bài tập Hóa 9 Bài 42: Luyện tập chương 4 : Hiđrocacbon - Nhiên liệu
Chương 5: Dẫn xuất của Hiđrocacbon. Polime
- Vở bài tập Hóa 9 Bài 44: Rượu etylic
- Vở bài tập Hóa 9 Bài 45: Axit axetic
- Vở bài tập Hóa 9 Bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic
- Vở bài tập Hóa 9 Bài 47: Chất béo
- Vở bài tập Hóa 9 Bài 48: Luyện tập: Rượu etylic, axit axetic và chất béo
- Vở bài tập Hóa 9 Bài 50: Glucozơ
- Vở bài tập Hóa 9 Bài 51: Saccarozơ
- Vở bài tập Hóa 9 Bài 52: Tinh bột và xenlulozơ
- Vở bài tập Hóa 9 Bài 53: Protein
- Vở bài tập Hóa 9 Bài 54: Polime
- Vở bài tập Hóa 9 Bài 56: Ôn tập cuối năm: Phần 1: Hóa vô cơ
- Vở bài tập Hóa 9 Bài 56: Ôn tập cuối năm: Phần 2: Hóa hữu cơ
Vở bài tập Hóa học 9 Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
I. TÍNH CHẤT HOÁ HỌC CỦA OXIT
1. Oxit bazơ: Oxit bazơ có những tính chất hóa học nào ?
a) Một số oxit bazơ tác dụng với nước tạo thành dung dịch bazơ (kiềm).


II. KHÁI QUÁT VỀ SỰ PHÂN LOẠI OXIT
1. Oxit bazơ là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
2. Oxit axit là những oxit tác dụng với dung dich bazơ tạo thành muối và nước.
3. Oxit lưỡng tính là những oxit tác dụng với dung dịch axit và tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: Al2O3, ZnO,...
4. Oxit trung tính (oxit không tạo muối) là những oxit không tác dung với axit, bazơ, nước.
Ví dụ: CO
Bài 1. (Trang 6 Vở Bài Tập Hóa học 9 ) Có những oxit sau: CaO, Fe2O3, SO3. Oxit nào có thể tác dụng được với
a) Nước ?
b) axit clohiđric ?
c) natri hiđroxit ?
Viết phương trình hóa học.

Bài 2. (Trang 6 Vở Bài Tập Hóa học 9) Có những chất sau: 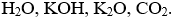
Lời giải:

Bài 3. (Trang 6 Vở Bài Tập Hóa học 9) Từ những chất: Canxi oxit, lưu huỳnh đioxit, cacbon đioxit, lưu huỳnh trioxit, kẽm oxit, em hãy chọn chất thích hợp điền vào các sơ đồ phản ứng sau:
a) Axit sunfuric + ... → Kẽm sunfat + Nước
b) Natri hiđroxit + ... → Natri sunfat + Nước
c) Nước + ... → Axit sunfurơ
d) Nước + ... → Canxi hiđroxit
e) Canxi oxit + ... → Canxi cacbonat
Dùng các công thức hóa học để viết tất cả những phương trình hóa học của các sơ đồ phản ứng trên.
Lời giải:
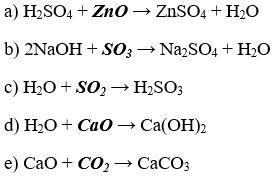
Bài 4. (Trang 6 Vở Bài Tập Hóa học 9) Cho những oxit sau: CO2, SO2, Na2O, CaO, CuO. Hãy chọn những chất đã cho tác dụng được với
a) Nước, tạo thành dung dịch axit
b) Nước, tạo thành dung dịch bazơ
c) Dung dịch axit, tạo thành muối và nước.
d) Dung dịch bazơ, tạo thành muối và nước.
Viết các phương trình hóa học.
Lời giải:
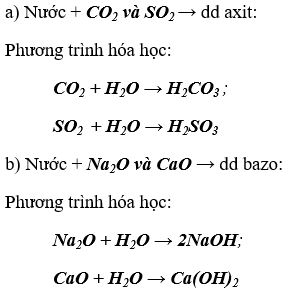

Bài 5. (Trang 6 Vở Bài Tập Hóa học 9) Có hỗn hợp khí CO2 và O2 làm thế nào có thể thu được khí O2 từ hỗn hợp trên? Trình bày cách làm và viết phương trình hóa học.
Lời giải:
Cách thu khí O2 từ hỗn hợp O2 và CO2 : Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư khí CO2 bị hấp thụ hết do có phản ứng với kiềm. Khí thoát ra khỏi bình chỉ có O2
Phương trình hóa học: CO2 + Ca(OH)2 → H2O + CaCO3
Bài 6. (Trang 6 Vở Bài Tập Hóa học 9) Cho 1,6 gam đồng (II) oxit tác dụng với 100 gam dung dịch axit sunfuric có nồng độ 20%.
a) Viết phương trình hóa học.
b) Tính nồng độ phần trăm của các chất có dung dịch sau khi phản ứng kết thúc.
Lời giải:
a) Phương trình hóa học: CuO + H2SO4 → CuSO4 + H2O
b) Nồng độ phần trăm các chất trong dung dịch: 0,18 mol H2SO4 và 0,02 mol CuSO4
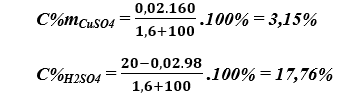
Bài 1. (Trang 7 Vở Bài Tập Hóa học 9) Lưu huỳnh đioxit (SO2) tác dụng được với:
A. nước, sản phẩm là bazo.
B. axit, sản phẩm là bazo.
C. nước, sản phẩm là axit.
D. bazo, sản phẩm là axit.
Lời giải:
Kết quả đúng: C
Oxit axit tác dụng với nước tạo thành axit
Bài 2. (Trang 7 Vở Bài Tập Hóa học 9) 0,05 mol Na2O tác dụng vừa đủ với:
A. 0,02 mol HCl.
B. 0,1 mol HCl.
C. 0,02 mol CaO.
D. 0,01 mol CaO.
Lời giải:
Kết quả đúng: B
Phương trình hóa học:
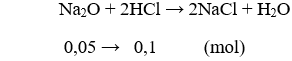
Vậy 0,05 mol Na2O tác dụng vừa đủ với 0,1 mol HCl
Bài 3. (Trang 7 Vở Bài Tập Hóa học 9) Đồng (II) oxit (CuO) tác dụng được với:
A. nước, sản phẩm là axit.
B. nước, sản phẩm là bazo.
C. axit, sản phẩm là muối và nước.
D. bazo, sản phẩm là muối và nước.
Lời giải:
Kết quả đúng: C
CuO + 2HCl → CuCl2 + 2H2O
Vở bài tập Hóa học 9 Bài 2: Một số oxit quan trọng: Canxi Oxit
I. CANXI OXIT CÓ NHỮNG TÍNH CHẤT NÀO ?
Canxi oxit là chất rắn , màu trắng , nóng chảy ở nhiệt độ rất cao.
Canxi oxit có đầy đủ tính chất của oxit bazo .
1. Tác dụng mạnh với nước sản phẩm là bazo (phản ứng tỏa nhiệt)
Phương trình hóa học: CaO + H2O → Ca(OH)2
2. Tác dụng mạnh với dung dịch axit HCl sản phẩm là muối CaCl2 và nước.
Phương trình hóa học: CaO + 2HCl → CaCl2 + H2O
3. Tác dụng với oxit axit sản phẩm là muối.
Phương trình hóa học: CaO + CO2 → CaCO3
Kết luận về tính chất hóa học của canxi oxit: canxi oxit là oxit bazo.
II. CANXI OXIT CÓ NHỮNG ỨNG DỤNG GÌ?
- Phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học.
- Canxi oxit còn được dùng để khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm, khử độc môi trường,…
- Canxi oxit có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
III. SẢN XUẤT CANXI OXIT NHƯ THẾ NÀO?
Sản xuất canxi oxit trong công nghiệp
1. Nguyên liệu: đá vôi (chứa CaCO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
2. Các phương trình hóa học:
- Than cháy sinh ra khí CO2 và tỏa nhiều nhiệt: C + O2 → CO2
- Nhiệt sinh ra phân hủy đá vôi ở khoảng trên 900˚C: CaCO3 → CaO + CO2
I. CANXI OXIT CÓ NHỮNG TÍNH CHẤT NÀO ?
Canxi oxit là chất rắn , màu trắng , nóng chảy ở nhiệt độ rất cao.
Canxi oxit có đầy đủ tính chất của oxit bazo .
1. Tác dụng mạnh với nước sản phẩm là bazo (phản ứng tỏa nhiệt)
Phương trình hóa học: CaO + H2O → Ca(OH)2
2. Tác dụng mạnh với dung dịch axit HCl sản phẩm là muối CaCl2 và nước.
Phương trình hóa học: CaO + 2HCl → CaCl2 + H2O
3. Tác dụng với oxit axit sản phẩm là muối.
Phương trình hóa học: CaO + CO2 → CaCO3
Kết luận về tính chất hóa học của canxi oxit: canxi oxit là oxit bazo.
II. CANXI OXIT CÓ NHỮNG ỨNG DỤNG GÌ?
- Phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học.
- Canxi oxit còn được dùng để khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm, khử độc môi trường,…
- Canxi oxit có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
III. SẢN XUẤT CANXI OXIT NHƯ THẾ NÀO?
Sản xuất canxi oxit trong công nghiệp
1. Nguyên liệu: đá vôi (chứa CaCO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
2. Các phương trình hóa học:
- Than cháy sinh ra khí CO2 và tỏa nhiều nhiệt: C + O2 → CO2
- Nhiệt sinh ra phân hủy đá vôi ở khoảng trên 900˚C: CaCO3 → CaO + CO2
Bài 1. (Trang 8 Vở Bài Tập Hóa học 9 ) Bằng phương pháp hóa học nào có thể nhận biết được từng chất trong mỗi dãy chất sau ?
a) Hai chất rắn màu trắng là CaO và Na2O.
b) Hai chất khí không màu là CO2 và O2.
Lời giải:
a) Nhận biết hai chất rắn CaO và Na2O : Hòa tan 2 chất vào 2 cốc nước, lọc lấy dung dịch, sau đó dẫn khí CO2 qua mỗi dung dịch. Dung dịch nào xuất hiện kết tủa (Ca(OH)2) thì ban đầu là CaO
b) Nhận biết hai khí O2 và CO2: Cho tàn đóm đỏ vào từng khí.Khí nào làm tàn đóm bùng cháy trở lại là khí O2 còn lại là CO2
Bài 2. (Trang 8 Vở Bài Tập Hóa học 9 ) Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học.
a) CaO, CaCO3;
b) CaO, MgO.
Lời giải:
a) Nhận biết CaO và CaCO3 : Cho 2 chất vào 2 ông nghiêm chứa nước. Ống nào thấy chất rắn tan thì đó là CaO
CaO + H2O → Ca(OH)2
b) Nhận biết CaO và MgO: Cho 2 chất vào 2 ông nghiêm chứa nước. Ống nào thấy chất rắn tan thì đó là CaO
CaO + H2O → Ca(OH)2
Bài 3. (Trang 9 Vở Bài Tập Hóa học 9 ) 200ml dung dịch HCl có nồng độ 3,5M hòa tan vừa hết 20 g hỗn hợp hai oxit CuO và Fe2O3
a) Viết các phương trình hóa học
b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu.
Lời giải:
a) Các phương trình hóa học:
CuO + 2HCl → CuCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Khối lượng của mỗi oxit trong hỗn hợp: x + y = 20; nHCl = 3,5.0,2 = 0,7 mol
Gọi khối lượng của CuO trong hỗn hợp là x và Fe2O3 là y (gam).
Từ (1) và (2) ta có:
x + y = 20
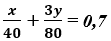
Giải hệ phương trình ta được x = 4 gam và y = 16 gam.
Bài 4. (Trang 9 Vở Bài Tập Hóa học 9 ) Biết 2,24 lít khí CO2 (đktc) tác dụng vừa hết với 200 ml dung dịch Ba(OH)2 sản phẩm là BaCO3 và H2O
a) Viết phương trình hóa học
b) Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng
c) Tính khối lượng chất kết tủa thu được.
Lời giải:
a) Phương trình hóa học: CO2 + Ba(OH)2 → BaCO3 + H2O
b) Nồng độ mol của dung dịch Ba(OH)2 :
nCO2 = 0,1mol
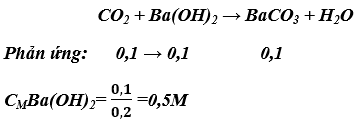
c) Khối lượng kết tủa :
Chất kết tủa thu được sau phản ứng là BaCO3 có số mol là 0,1
mBaCO3 = 0,1 × 197 = 19,7g
Bài 1. (Trang 9 Vở Bài Tập Hóa học 9) Sản xuất vôi sống CaO bằng cách nung đá vôi (thành phần chính là canxi cacbonat CaCO3).
a) Viết phương trình hóa học.
b) Từ 1 tấn đá vôi có chứa 80% canxi cacbonat có thể sản xuất được bao nhiêu tấn vôi sống?
Lời giải:
a) Phương trình hóa học: CaCO3 → CaO + CO2
b) Khối lượng vôi sống sản xuất được:
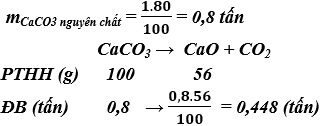
Bài 2. (Trang 9 Vở Bài Tập Hóa học 9) Hãy thực hiện các thí nghiệm để loại bỏ tạp chất ra khỏi hỗn hợp sau:
a) Khí O2 lẫn tạp chất là CO2.
b) Không khí (hỗn hợp N2 và O2) có lẫn tạp chất là SO2.
c) Bột CaCO3 có lẫn tạp chất là CaO.
Lời giải:
a) Loại bỏ tạp chất CO2 lẫn với O2 : Dẫn hỗn hợp qua dung dịch nước vôi trong Ca(OH)2 . CO2 phản ứng với Ca(OH)2 tạo kết tủa trắng và bị giữ lại trong dung dịch.
Phương trình hóa học: Ca(OH)2 + CO2 → CaCO3 + H2O
b) Loại bỏ tạp chất SO2 có trong không khí: Dẫn hỗn hợp qua dung dịch nước vôi trong Ca(OH)2 . SO2 phản ứng với Ca(OH)2 tạo kết tủa trắng và bị giữ lại trong dung dịch.
Phương trình hóa học: Ca(OH)2 + SO2 → CaSO3 + H2O
c) Loại bỏ tạp chất CaO khỏi CaCO3: CaO tác dụng với CO2 tạo thành CaCO3
Phương trình hóa học: CaO + CO2⟶ CaCO3
Bài 3. (Trang 9 Vở Bài Tập Hóa học 9) Khối lượng Ca(OH)2 sản xuất được từ 112kg CaO tác dụng với H2O là
A. 74 kg B. 148 kg C. 14,8 kg D. 7,4 kg
Lời giải:
Kết quả đúng: B
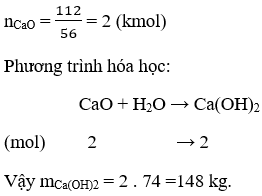
Vở bài tập Hóa học 9 Bài 2: Một số oxit quan trọng: Lưu huỳnh Đioxit
I. LƯU HUỲNH ĐIOXIT CÓ NHỮNG TÍNH CHẤT GÌ?
Lưu huỳnh Đioxit là chất khí không màu, mùi hắc, độc (gây ho, viêm đường hô hấp…), nặng hơn không khí.

II. LƯU HUỲNH ĐIOXIT CÓ NHỮNG ỨNG DỤNG GÌ?
- Phần lớn SO2 dùng để sản xuất axit sunfuric H2SO4.
- Dùng làm chất tẩy trắng bột gỗ trong sản xuất giấy, đường,…
- Dùng làm chất diệt nấm mốc,…
III. ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT NHƯ THẾ NÀO?
1. Trong phòng thí nghiệm: Cho muối sunfit khi tác dụng với axit mạnh như HCl, H2SO4,…
Phương trình hóa học: Na2SO3(tt) + H2SO4 → Na2SO4 + SO2 + H2O
2. Trong công nghiệp: Đốt lưu huỳnh hoặc quặng pirit sắt FeS2 trong không khí:
S + O2 → SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Bài 1. (Trang 11 Vở Bài Tập Hóa học 9 ) Viết phương trình hóa học cho mỗi chuyển đổi
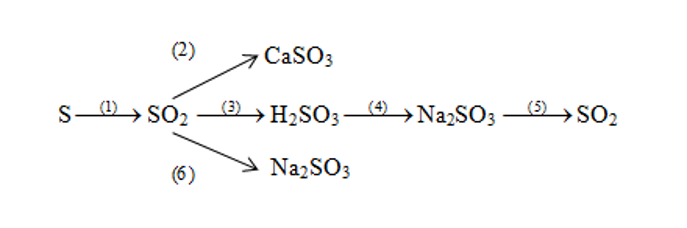
Lời giải:
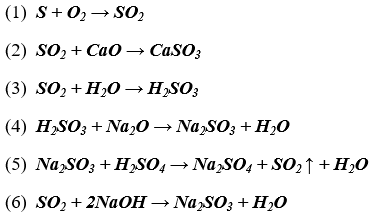
Bài 2. (Trang 11 Vở Bài Tập Hóa học 9 ) Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học
a) Hai chất rắn màu trắng là CaO và P2O5
b) Hai chất khí không màu là SO2 và O2
Lời giải:
Nhận biết các chất:
a) CaO và P2O5: Cho nước vào hai ống nghiệm có chứa CaO và P2O5. Sau đó cho quỳ tím vào mỗi dung dịch. Qùy tím chuyển xanh thì chất ban đầu là CaO, còn lại chuyển đỏ là P2O5
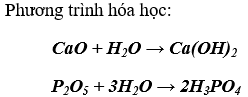
b) SO2 và O2 : Dẫn lần lượt từng khí vào dung dịch nước vôi trong, nếu có kết tủa xuất hiện thì khí dẫn vào là SO2.
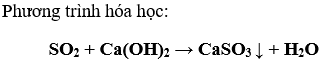
Bài 3. (Trang 11 Vở Bài Tập Hóa học 9 ) Có những khí ẩm (khí có lần hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào có thể được làm khô bằng canxi oxit? Giải thích.
Lời giải:
CaO có thể được dùng để làm khô các khí (bị ẩm) sau : H2, O2
Giải thích: CaO chỉ làm khô những chất không có phản ứng hóa học với CaO, đó là các chất H2, O2.
Bài 4. (Trang 11 Vở Bài Tập Hóa học 9 ) Có những chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho biết chất nào có tính chất sau:
a) nặng hơn không khí.
b) nhẹ hơn không khí
c) cháy được trong không khí.
d) tác dụng với nước tạo thành dung dịch axit
e) làm đục nước vôi trong
g) đổi màu giấy quỳ tím ẩm thành đỏ.
Lời giải:
a) Nặng hơn không khí: CO2 , O2, SO2
b) Nhẹ hơn không khí: H2 , N2
c) Cháy được trong không khí: H2
d) Tác dụng với nước tạo thành dung dịch axit: CO2, SO2
e) Làm đục nước vôi trong : CO2, SO2
g) Đổi màu giấy quỳ tím ẩm thành đỏ : CO2, SO2
Bài 5. (Trang 12 Vở Bài Tập Hóa học 9 ) Khí lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây ?
a) K2SO3 và H2SO4.
b) K2SO4 và HCl.
c) Na2SO3 và NaOH
d) Na2SO4 và CuCl2.
e) Na2SO3 và NaCl.
Lời giải:
Khí SO2 được tạo thành từ cặp chất: K2SO3 và H2SO4
Phương trình hóa học: K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O
Bài 6. (Trang 12 Vở Bài Tập Hóa học 9 ) Dẫn 112 ml khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 có nồng độ 0,01 M, sản phẩm là muối canxi sunfit.
a) Viết phương trình hóa học
b) Tính khối lượng các chất sau phản ứng.
Lời giải:
a) Phương trình phản ứng hóa học: SO2 + Ca(OH)2 → CaSO3 + H2O
b) Khối lượng các chất sau phản ứng:
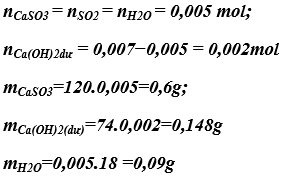
Bài 1. (Trang 12 Vở Bài Tập Hóa học 9) Có những chất sau: H2O, SO3, Na2O, KOH, Fe2O3, MgO, P2O5, CO2.
Những chất nào có thể tác dụng với nhau từng đôi một?
Viết các phương trình hóa học.
Lời giải:
Những chất có thể tác dụng với nhau từng đôi một:
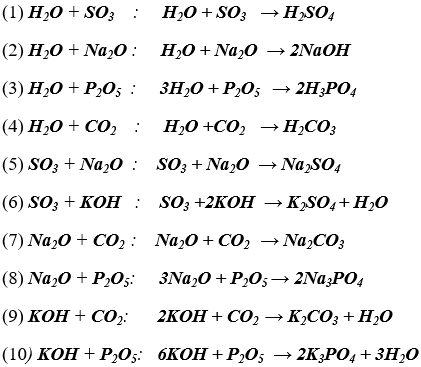
Bài 2. (Trang 12 Vở Bài Tập Hóa học 9) Hãy thực hiện những biến đổi sau bằng cách viết các phương trình hóa học:
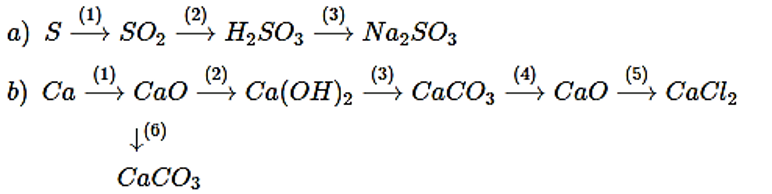
Lời giải: