Giải vở bài tập Hóa Học 9 Bài 29: Axit cacbonic và muối cacbonat
Giải vở bài tập Hóa Học 9 Bài 29: Axit cacbonic và muối cacbonat
Nhằm mục đích giúp học sinh dễ dàng làm bài tập về nhà trong Vở bài tập Hóa Học lớp 9, chúng tôi biên soạn giải vở bài tập Hóa Học lớp 9 Bài 29: Axit cacbonic và muối cacbonat hay nhất, ngắn gọn bám sát nội dung sách Vở bài tập Hóa Học 9.
Học theo Sách giáo khoa
I. AXIT CACBONIC (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000m3 nước hòa tan được 90 m3 khí CO2.
Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
- H2CO3 là một axit yếu, dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
II. MUỐI CACBONAT
1. Phân loại:
- Muối trung hòa. Không còn nguyên tố H trong thành phần gốc axit.
Thí dụ: Na2CO3, CaCO3,..
- Muối axit: Có nguyên tố H trong thành phần gốc axit.
Thí dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
- Tinh tan: Chỉ có một số muối cacbonat tan dược, như Na2CO3, K2CO3... và muối axit như Ca (HCO3)2,... Hầu hết muối cacbonat trung hòa không tan, như CaCO3, BaCO3, MgCO3...
c) Tính chất hóa học
- Muối cacbonat tác dụng với dd axit mạnh hơn (HCl, HNO3, H,SO4,...) tạo thành muối mới và CO2.
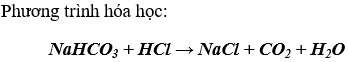
- Một số dd muối cacbonat tác dụng với dd bazơ tạo thành muối mới và bazo mới.
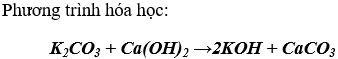
- Dd muối cacbonat tác dụng với một số dung dịch muối tạo thành 2 muối mới
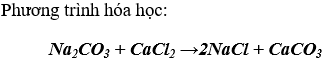
- Nhiều muối cacbonat (trừ Na2CO3, K2CO3,... )dễ bị nhiệt phân hủy giải phóng khí CO2
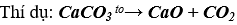
3. Ứng dụng:
- CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măngr..
- Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
III. CHU TRÌNH CACBON TRONG TỰ NHIÊN
Trong tự nhiên luôn có sự chuyển hóa cacbon tự dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
Bài tập
Bài 1. (Trang 86 Vở Bài Tập Hóa học 9 ) Hãy lấy thí dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền. Viết phương trình hoá học.
Lời giải:
* H2CO3 là axit yếu hơn axit HCl: axit cacbonic bị axit HCl đẩy ra khỏi muối.
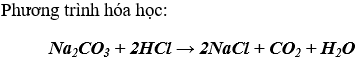
* H2СO3 là axit không bền: Axit H2СO3 tạo thành bị phân hủy thành khí CO2 và H2O
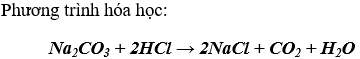
Bài 2. (Trang 86 Vở Bài Tập Hóa học 9 ) Dựa vào tính chất hoá học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hoá học minh hoạ.
Lời giải:
Tính chất của muối MgCO3 : xét điều kiện phản ứng, MgCO3 có các tính chất sau:
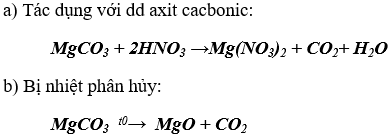
MgCO3 không tan trong nước nên không có phản ứng với dung dịch muối
Bài 3. (Trang 86 Vở Bài Tập Hóa học 9 ) Viết các phương trình hoá học biểu diễn chuyển đổi hoá học sau: C → CO2 → CaCO3 → CO2
Lời giải:
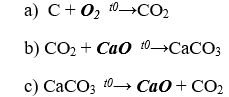
Bài 4. (Trang 86 Vở Bài Tập Hóa học 9 ) Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3 ;
b) K2CO3 và NaCl ;
c) MgCO3 và HCl;
d) CaCl2 và Na2CO3 ;
e) Ba(OH)2 và K2CO3;
Giải thích và viết các phương trinh hoá học.
Lời giải:
Các cặp chất có thể tác dụng với nhau vì tạo sản phẩm là chất khí hoặc chất không tan.
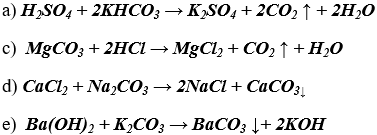
Bài 5. (Trang 86 Vở Bài Tập Hóa học 9 ) Hãy tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 g H2SO4 tác dụng hết với dung dịch NaHCO3.
Lời giải:

Theo pt, số mol CO2 tạo thành = 2.số mol H2SO4 phản ứng = 20 mol.
Thể tích khí CO2 tạo thành ở đktc = 20 x 22,4 = 448 lít.
Bài tập bổ sung
Bài 1. (Trang 87 Vở Bài Tập Hóa học 9 ) Viết các phương trình hóa học biểu diễn chuyển hóa sau đây:
CaCO3 → CO2 → NaHCO3 → Na2CO3 → BaCO3 → CO2
Lời giải:

Bài 2. (Trang 87 Vở Bài Tập Hóa học 9 ) Có 3 chất rắn là CaCO3, MgSO4, CaCl2. Hãy nêu phương pháp hóa học để nhận biết mỗi chất trong hỗn hợp. Viết các phương trình hóa học.
Lời giải:
Phương pháp dùng để nhận biết các chất CaCO3, MgSO4, CaCl2 trong hỗn hợp.
Dùng HCl để nhận biết CaCO3: hiện tượng là thấy xuất hiện sủi bọt khí CO2
Dùng Ba(OH)2 để nhận biết MgSO4 và CaCl2: MgSO4 phản ứng cho kết tủa trắng , còn lại là CaCl2
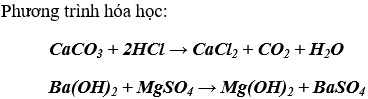
Bài 3. (Trang 87 Vở Bài Tập Hóa học 9 ) Có hỗn hợp A gồm bột của 2 chất rắn là CaCO3 và MgCl2. Người ta cho tiến hành thí nghiệm như sau:
Thí nghiệm 1: Cho hỗn hợp A phản ứng với dd HCl dư thì thu được 4,48 lít khí ở đktc
Thí nghiệm 2: Cần dùng 20ml dd NaOH 1M để phản ứng vừa đủ với hỗn hợp A.
Tính khối lượng của hỗn hợp A.
Lời giải:
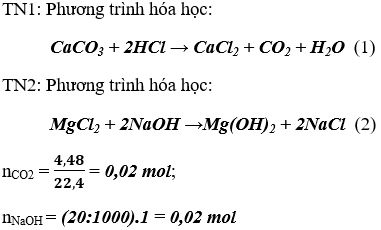
Khối lượng CaCO3 theo (1) = mCaCO3 = 0.2. 100 = 20 gam
Khối lượng MgCl2 theo (2) = mMgCl2 = 0,01 . 95 = 0,95 gam
Khối lượng hỗn hợp A: mA = mCaCO3 + mMgCl2 = 20 + 0,95 = 20,95 gam


