Lý thuyết Hóa học 9 Bài 26: Clo hay, chi tiết
Lý thuyết Hóa học 9 Bài 26: Clo hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa học 9 Bài 26: Clo hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 9.

I. TÍNH CHẤT VẬT LÍ
Clo là chất khí , màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí 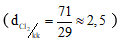
Tác dụng sinh lí: Clo là một khí độc.
II. TÍNH CHẤT HÓA HỌC
1. Clo có những tính chất hóa học của phi kim
a) Tác dụng kim loại → muối clorua
Clo phản ứng với với hầu hết kim loại tạo thành muối clorua
Ví dụ:
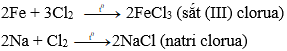
b) Tác dụng hiđro → khí hiđro clorua
Phương trình hóa học:
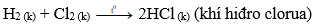
Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit clohiđric.
Chú ý: Clo không phản ứng trực tiếp với oxi.
2. Tính chất hóa học khác của clo
a) Tác dụng với nước
Phương trình hóa học:
Cl2 (k) + H2O (l) ⇄ HCl (dd) + HClO (dd)
Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO có màu vàng lục, mùi hắc.
Khi cho quỳ tím vào nước clo, lúc đầu dung dịch làm quỳ tím hóa đỏ, sau đó nhanh chóng mất màu do tác dụng oxi hóa mạnh của axit hipoclorơ HClO.
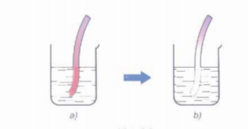
Hình 1: Minh họa cho quỳ tím vào nước clo
Nước clo có tính tẩy màu, sát trùng.
b) Tác dụng với dung dịch kiềm (NaOH, KOH, …)
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Gia - ven là hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO). Dung dịch này có tính tẩy màu tương tự nước clo.
III. ỨNG DỤNG CỦA CLO
- Nước clo dùng khử trùng nước sinh hoạt.
- Tẩy trắng vải sợi, bột giấy....
- Điều chế nước Gia - ven, clorua vôi...
- Điều chế nhựa PVC, chất dẻo, chất màu...
IV. ĐIỀU CHẾ KHÍ CLO
1. Trong phòng thí nghiệm
Phương pháp: Đun nóng nhẹ dung dịch HCl đậm đặc với các chất oxi hóa mạnh như MnO2, KMnO4,...
Ví dụ:
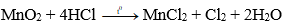
Thu khí clo bằng cách đẩy không khí.

Hình 2: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
Phương pháp: Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)

Hình 3: Sản xuất clo trong công nghiệp

