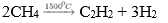Lý thuyết Hóa học 9 Bài 38: Axetilen hay, chi tiết
Lý thuyết Hóa học 9 Bài 38: Axetilen hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa học 9 Bài 38: Axetilen hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 9.

Công thức phân tử axetilen: C2H2
Phân tử khối: 26
I. TÍNH CHẤT VẬT LÍ
Axetilen là chất khí, không màu, không mùi, nhẹ hơn không khí 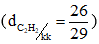
II. CẤU TẠO PHÂN TỬ
Axetien có công thức cấu tạo: H – C ≡ C– H; viết gọn HC ≡ CH.
Trong phân tử axetilen có một liên kết ba giữa hai nguyên tử cacbon.
Chú ý:
Trong liên kết ba, có hai liên kết kém bền, dễ đứt lần lượt trong các phản ứng hóa học.
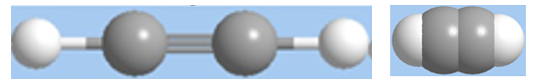
Hình 1: Mô hình phân tử axetilen dạng rỗng và dạng đặc.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
Khí axetilen cháy tỏa nhiều nhiệt, sản phẩm sinh ra gồm CO2 và nước tương tự metan và etilen.
Phương trình hóa học:
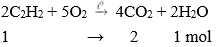
Nhận xét: Khi đốt cháy axetilen thu được số mol CO2 lớn hơn số mol H2O.
2. Phản ứng cộng với dung dịch brom
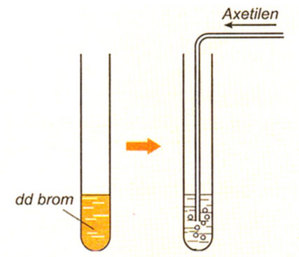
Hình 2: Mô phỏng thí nghiệm axetilen tác dụng với dung dịch brom.
Phương trình hóa học:
HC ≡ CH + Br2 → Br–CH=CH– Br
Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với 1 phân tử brom nữa
Br–CH=CH– Br + Br2 → Br2CH–CHBr2
Tổng quát: HC≡CH + 2Br2 → Br2CH–CHBr2
Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2...
IV. ỨNG DỤNG
Axetilen dùng làm nhiên liệu trong đèn xì oxi–axetilen để hàn, cắt kim loại.
Trong công nghiệp Axetilen là nguyên liệu để sản xuất poli (vinyl clorua) dùng sản xuất nhựa PVC và nhiều hóa chất khác.
V. ĐIỀU CHẾ
Trong phòng thí nghiệm axetilen được điều chế bằng cách cho canxi cacbua (thành phần chính của đất đèn) phản ứng với nước.
CaC2 + 2H2O → C2H2 + Ca(OH)2
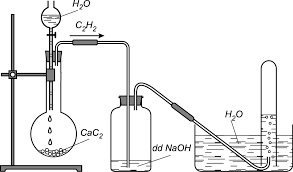
Hình 3: Điều chế và thu khí axetilen trong phòng thí nghiệm
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao, sau đó làm lạnh nhanh.