Tổng hợp lý thuyết Hóa học 9 Chương 2 chi tiết
Tổng hợp lý thuyết Hóa học 9 Chương 2 chi tiết
Nhằm mục đích giúp học sinh nắm vững kiến thức cũng như lý thuyết môn Hóa học lớp 9 Chương 2: Kim loại, loạt bài này sẽ tổng hợp, tóm tắt, hệ thống kiến thức lý thuyết Hóa học 9 theo từng bài học.

- Lý thuyết Bài 15: Tính chất vật lí của kim loại (hay, chi tiết)
- Lý thuyết Bài 16: Tính chất hóa học của kim loại (hay, chi tiết)
- Lý thuyết Bài 17: Dãy hoạt động hóa học của kim loại (hay, chi tiết)
- Lý thuyết Bài 18: Nhôm (hay, chi tiết)
- Lý thuyết Bài 19: Sắt (hay, chi tiết)
- Lý thuyết Bài 20: Hợp kim sắt: Gang, thép (hay, chi tiết)
- Lý thuyết Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn (hay, chi tiết)
- Lý thuyết Bài 22: Luyện tập chương 2: Kim loại (hay, chi tiết)
- Lý thuyết Bài 24: Ôn tập học kì 1 (hay, chi tiết)
Lý thuyết Hóa 9 Bài 15: Tính chất vật lí của kim loại
I. TÍNH DẺO
Kim loại có tính dẻo.
Nhờ có tính dẻo, kim loại có thể dát mỏng, kéo thành sợi,... tạo nên các đồ vật khác nhau.
Các kim loại khác nhau có độ dẻo khác nhau. Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, ...
II. TÍNH DẪN ĐIỆN
Kim loại có tính dẫn điện.
Nhờ có tính dẫn điện mà một số kim loại được sử dụng làm dây dẫn điện. Các kim loại khác nhau có khả năng dẫn điện khác nhau. Những kim loại dẫn điện tốt nhất là Ag, Cu, Al, Fe,...
Chú ý: Không nên sử dụng dậy điện trần hoặc dây điện đã hỏng lớp bọc cách điện để tránh bị điện giật hay cháy do chập điện…
III. TÍNH DẪN NHIỆT
Kim loại có tính dẫn nhiệt.
Nhờ có tính dẫn nhiệt mà một số kim loại được dùng để làm dụng cụ nấu ăn.
Kim loại nào dẫn điện tốt thường cũng dẫn nhiệt tốt.
IV. ÁNH KIM
Kim loại có ánh kim (vẻ sáng lấp lánh).
Nhờ có ánh kim mà một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí như vàng, bạc...
Lý thuyết Hóa 9 Bài 16: Tính chất hóa học của kim loại
1. Tác dụng với phi kim
a) Tác dụng với oxi:
Hầu hết kim loại (trừ Au, Pt, Ag,..) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
Ví dụ:
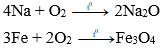
b) Tác dụng với phi kim khác (Cl2, S, ...):
Nhiều kim loại tác dụng với nhiều phi kim, tạo thành muối.
Ví dụ:
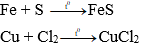
2. Tác dụng với dung dịch axit
Nhiều kim loại tác dụng với dung dịch axit (HCl, H2SO4 loãng...) tạo thành muối và H2.
Ví dụ:
Fe + 2HCl → FeCl2 + H2
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
3. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn (trừ các kim loại phản ứng với nước như Na, K, Ba, Ca...) tác dụng với muối của kim loại yếu hơn, tạo thành muối mới và kim loại mới.
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Mg + FeCl2 → MgCl2 + Fe

