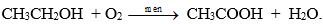Tổng hợp lý thuyết Hóa học 9 Chương 5 chi tiết
Tổng hợp lý thuyết Hóa học 9 Chương 5 chi tiết
Nhằm mục đích giúp học sinh nắm vững kiến thức cũng như lý thuyết môn Hóa học lớp 9 Chương 5: Dẫn xuất của Hiđrocacbon. Polime, loạt bài này sẽ tổng hợp, tóm tắt, hệ thống kiến thức lý thuyết Hóa học 9 theo từng bài học.

- Lý thuyết Bài 44: Rượu etylic (hay, chi tiết)
- Lý thuyết Bài 45: Axit axetic (hay, chi tiết)
- Lý thuyết Bài 46: Mối liên hệ giữa etilen, rượu etylic và axit axetic (hay, chi tiết)
- Lý thuyết Bài 47: Chất béo (hay, chi tiết)
- Lý thuyết Bài 48: Luyện tập: Rượu etylic, axit axetic và chất béo (hay, chi tiết)
- Lý thuyết Bài 50: Glucozơ (hay, chi tiết)
- Lý thuyết Bài 51: Saccarozơ (hay, chi tiết)
- Lý thuyết Bài 52: Tinh bột và xenlulozơ (hay, chi tiết)
- Lý thuyết Bài 53: Protein (hay, chi tiết)
- Lý thuyết Bài 54: Polime (hay, chi tiết)
- Lý thuyết Bài 56: Ôn tập cuối năm (hay, chi tiết)
Lý thuyết Hóa 9 Bài 44: Rượu etylic
Công thức phân tử rượu etylic: C2H6O
Phân tử khối: 46
I. TÍNH CHẤT VẬT LÍ
Rượu etylic (hay ancol etylic hoặc etanol) là chất lỏng, không màu, sôi ở 78,3°C, nhẹ hơn nước, tan vô hạn trong nước và hòa tan được nhiều chất như iot, benzen…
Độ rượu là số ml rượu etylic có trong 100 ml hỗn hợp rượu với nước
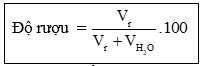
Trong đó: Vr là thể tích rượu nguyên chất.
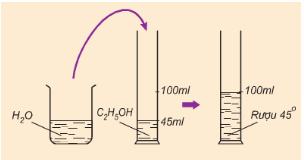
Hình 1: Cách pha rượu 45o
II. CẤU TẠO PHÂN TỬ
Rượu etylic có công thức cấu tạo: 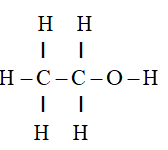
Nhận xét: Trong phân tử rượu etylic có một nguyên tử hiđro không liên kết với nguyên tử cacbon mà liên kết với nguyên tử oxi, tạo ra nhóm -OH. Chính nhóm -OH này làm cho rượu có tính chất đặc trưng.
III. TÍNH CHẤT HÓA HỌC.
a) Phản ứng cháy
Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
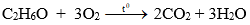
b) Tác dụng với kim loại mạnh như K, Na,... giải phóng khí H2
Ví dụ:
2CH3 – CH2 – OH + 2Na → 2CH3 – CH2 – ONa + H2.
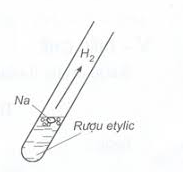
Hình 2: Minh họa thí nghiệm rượu etylic tác dụng với Na.
c) Tác dụng với axit axetic
Rươu etylic tác dụng với axit axetic thu được este.
Phương trình hóa học:
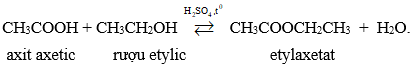
IV) ỨNG DỤNG.
Rượu etylic có nhiều ứng dụng như:
- Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp, các loại đồ uống.
- Làm nhiên liệu cho động cơ; nhiên liệu cho đèn cồn trong phòng thí nghiệm…
- Làm dung môi pha vecni, nước hoa…
V) ĐIỀU CHẾ
Rượu etylic thường được điều chế theo các cách sau:
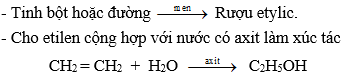
Lý thuyết Hóa 9 Bài 45: Axit axetic
Axit axetic có công thức phân tử: C2H4O2.
Phân tử khối: 60.
I. TÍNH CHẤT VẬT LÍ
Axit axetic là chất lỏng, không màu, vị chua, tan vô hạn trong nước.
Dung dịch axit axetic nồng độ từ 2 – 5 % dùng làm giấm ăn.
II. CẤU TẠO PHÂN TỬ
Axit axetic có công thức cấu tạo: 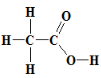
Trong phân tử axit axetic có nhóm –COOH làm cho phân tử có tính axit.
III. TÍNH CHẤT HÓA HỌC
1. Axit axetic có tính chất của một axit
+ Làm đổi màu quỳ tím sang màu đỏ.
+ Tác dụng với kim loại (trước H) giải phóng H2
Ví dụ: 2CH3COOH + 2Na → 2CH3COONa + H2
+ Tác dụng với bazơ → muối và nước
Ví dụ: CH3COOH + NaOH → CH3COONa + H2O
+ Tác dụng với oxit bazơ → muối và nước
Ví dụ: 2CH3COOH + CaO → (CH3COO)2Ca + H2O
+ Tác dụng với muối của axit yếu hơn
Ví dụ: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O.
Chú ý : Axit axetic là axit yếu.
2. Tác dụng với rượu etylic tạo ra este và nước
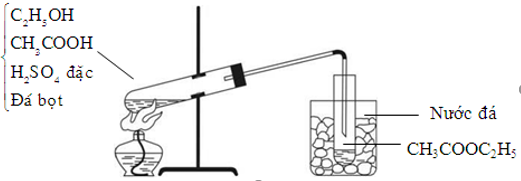
Hình 1: Minh họa thí nghiệm axit axetic tác dụng với rượu etylic.
Phương trình hóa học:
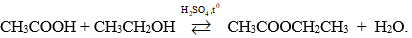
Este thu được là etylaxetat là chất lỏng, mùi thơm, ít tan trong nước, dùng làm dung môi trong công nghiệp.
IV. ỨNG DỤNG
Axit axetic được dùng để điều chế dược phẩm, thuốc diệt cỏ, diệt côn trùng, phẩm nhuộm, tơ sợi nhân tạo, pha giấm ăn…
V. ĐIỀU CHẾ
Axit axetic được điều chế theo các phản ứng sau:
- Trong công nghiệp, đi từ butan C4H10:
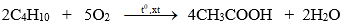
- Sản xuất giấm ăn, thường dùng phương pháp lên men dung dịch rượu etylic loãng.