Lý thuyết Hóa học 9 Bài 28: Các oxit của cacbon hay, chi tiết
Lý thuyết Hóa học 9 Bài 28: Các oxit của cacbon hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa học 9 Bài 28: Các oxit của cacbon hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 9.

I. CACBON OXIT (Công thức hóa học CO)
1. Tính chất vật lí
CO là chất khí, không màu, không mùi, hơi nhẹ hơn không khí 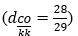
2. Tính chất hóa học
a) CO là oxit trung tính
Ở điều kiện thường không phản ứng với nước, kiềm và axit.
b) CO là chất khử
- Ở nhiệt độ cao, cacbon oxit khử được nhiều oxit kim loại
Ví dụ:
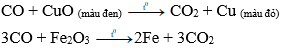
- CO cháy trong oxi hoặc trong không khí với ngọn lửa màu xanh, tỏa nhiều nhiệt.
Phương trình hóa học:
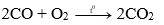
3. Ứng dụng
Khí CO được dùng làm nhiên liệu, chất khử… trong công nghiệp. Ngoài ra còn được dùng làm nguyên liệu trong công nghiệp hóa học.
II. CACBON ĐIOXIT (công thức hóa học CO2)
1. Tính chất vật lí
CO2 là chất khí, không màu, không mùi, nặng hơn không khí 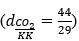
CO2 bị nén và làm lạnh thì hóa rắn được gọi là nước đá khô (tuyết cacbonic). Nước đá khô được dùng để bảo quản thực phẩm.
2. Tính chất hóa học: CO2 là một oxit axit.
a) Tác dụng với nước tạo thành axit cacbonic
Phương trình hóa học:
CO2 + H2O ⇄ H2CO3
Chú ý: CO2 phản ứng với nước tạo thành dung dịch axit, làm quỳ tím chuyển sang màu đỏ. H2CO3 không bền, dễ phân hủy thành CO2 và nước, khi đun nóng dung dịch thu được sẽ lại làm quỳ màu đỏ chuyển sang màu tím.
b) Tác dụng với dung dịch bazơ
Khí CO2 tác dụng với dung dịch bazơ tạo thành muối và nước. Tùy theo tỉ lệ số mol giữa CO2 và dung dịch bazơ mà có thể tạo ra muối trung hòa, muối axit hay hỗn hợp hai muối.
Ví dụ:
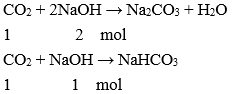
c) Tác dụng với oxit bazơ
CO2 tác dụng với oxit bazơ (tan) tạo thành muối.
Ví dụ:
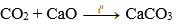
3. Ứng dụng
CO2 được dùng để chữa cháy, bảo quản thực phẩm.
Ngoài ra, CO2 còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,...

