Tổng hợp lý thuyết Hóa học 9 Chương 4 chi tiết
Tổng hợp lý thuyết Hóa học 9 Chương 4 chi tiết
Nhằm mục đích giúp học sinh nắm vững kiến thức cũng như lý thuyết môn Hóa học lớp 9 Chương 4: Hiđrocacbon. Nhiên liệu, loạt bài này sẽ tổng hợp, tóm tắt, hệ thống kiến thức lý thuyết Hóa học 9 theo từng bài học.

- Lý thuyết Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ (hay, chi tiết)
- Lý thuyết Bài 35: Cấu tạo phân tử hợp chất hữu cơ (hay, chi tiết)
- Lý thuyết Bài 36: Metan (hay, chi tiết)
- Lý thuyết Bài 37: Etilen (hay, chi tiết)
- Lý thuyết Bài 38: Axetilen (hay, chi tiết)
- Lý thuyết Bài 39: Benzen (hay, chi tiết)
- Lý thuyết Bài 40: Dầu mỏ và khí thiên nhiên (hay, chi tiết)
- Lý thuyết Bài 41: Nhiên liệu (hay, chi tiết)
- Lý thuyết Bài 42: Luyện tập chương 4 : Hiđrocacbon - Nhiên liệu (hay, chi tiết)
Lý thuyết Hóa 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
I. KHÁI NIỆM VỀ HỢP CHẤT HỮU CƠ
1. Hợp chất hữu cơ có ở đâu?
Hợp chất hữu cơ có ở xung quanh ta, trong cơ thể sinh vật và trong hầu hết các loại lương thực, thực phẩm, trong các loại đồ dùng và ngay trong cơ thể con người.

Hình 1: Một số loại thực phẩm, đồ dùng chứa hợp chất hữu cơ
2. Hợp chất hữu cơ là gì?
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, H2CO3, muối cacbonat, cacbua kim loại như CaC2...)
Khi đốt cháy các hợp chất hữu cơ đều thấy tạo ra CO2.
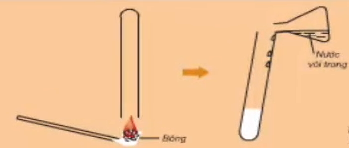
Hình 2: Thí nghiệm chứng tỏ bông chứa cacbon
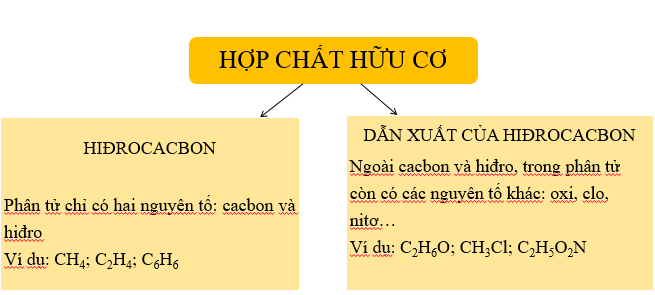
3. Phân loại hợp chất hữu cơ
Hợp chất hữu cơ được phân thành hai loại chính như sau:
II. KHÁI NIỆM VỀ HÓA HỌC HỮU CƠ
Hóa học hữu cơ là ngành hóa học chuyên nghiên cứu về các hợp chất hữu cơ và những chuyển đổi của chúng.
Hóa học hữu cơ có các phân ngành như hóa học dầu mỏ, hóa học polime, hóa học các hợp chất thiên nhiên...
Hóa học hữu cơ có vai trò quan trọng trong sự phát triển kinh tế, xã hội.
Lý thuyết Hóa 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
I. ĐẶC ĐIỂM CẤU TẠO PHÂN TỬ HỢP CHẤT HỮU CƠ
1. Hóa trị và liên kết giữa các nguyên tử
- Trong các hợp chất hữu cơ, cacbon luôn có hóa trị IV, hiđro có hóa trị I, oxi có hóa trị II.
- Các nguyên tử liên kết với nhau theo đúng hóa trị của chúng. Mỗi liên kết được biểu diễn bằng một nét gạch nối giữa hai nguyên tử.
- Ví dụ với phân tử CH4:
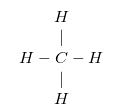
+) Nguyên tử C liên kết với 4 nguyên tử H, nguyên tử C có hóa trị IV.
+) Nguyên tử H có hóa trị I nên mỗi nguyên tử H tạo được 1 liên kết với nguyên tử cacbon.
2. Mạch cacbon
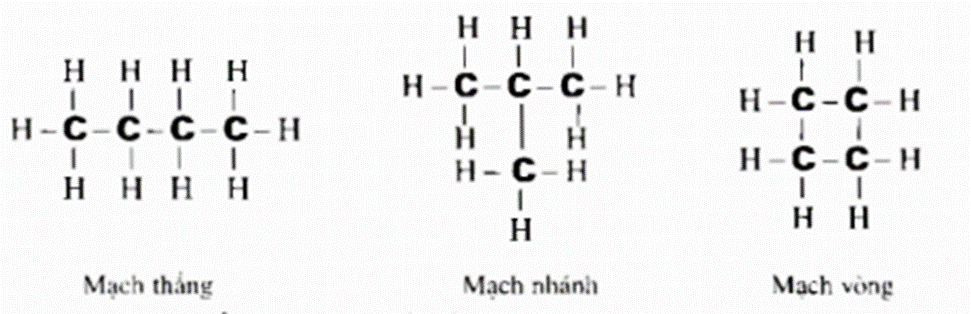
- Những nguyên tử cacbon trong phân tử hợp chất hữu cơ có thể liên kết trực tiếp với nhau tạo thành mạch cacbon.
- Có 3 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh và mạch vòng.
-
Ví dụ:
3. Trật tự liên kết giữa các nguyên tử trong phân tử
- Mỗi hợp chất hữu cơ có một trật tự liên kết giữa các nguyên tử trong phân tử.
- Ví dụ cùng công thức phân tử C2H6O có 2 chất:
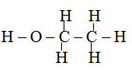
rượu etylic (chất lỏng)
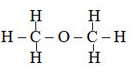
đimetyl ete (chất khí)
II. CÔNG THỨC CẤU TẠO
- Công thức biểu diễn đầy đủ liên kết giữa các nguyên tử trong phân tử gọi là công thức cấu tạo
Ví dụ:
Công thức cấu tạo của etan: 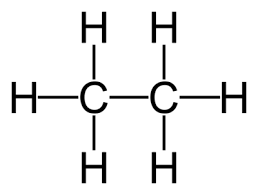
Công thức cấu tạo của rượu etylic: 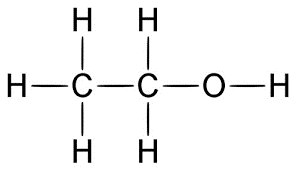
- Như vậy, công thức cấu tạo cho biết thành phần của phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.

