Lý thuyết Hóa học 9 Bài 3: Tính chất hóa học của axit hay, chi tiết
Lý thuyết Hóa học 9 Bài 3: Tính chất hóa học của axit hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa học 9 Bài 3: Tính chất hóa học của axit hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 9.

I. Tính chất hóa học của axit
1. Axit làm đổi màu chất chỉ thị màu
- Dung dịch axit làm đổi màu quỳ tím thành đỏ.
Ví dụ:
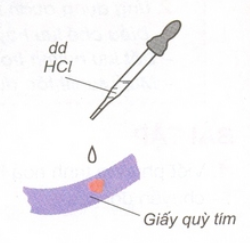
- Trong hóa học, quỳ tím là chất chỉ thị màu để nhận biết dung dịch axit.
2. Axit tác dụng với kim loại
- Dung dịch axit tác dụng được với nhiều kim loại tạo thành muối và giải phóng khí hiđro.
Ví dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
2HCl + Fe → FeCl2 + H2 (↑)
- Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl, H2SO4 loãng.
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng khí hiđro.
3. Axit tác dụng với bazơ: Axit + bazơ → muối + H2O
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
HCl + NaOH → NaCl + H2O
Phản ứng của axit với bazơ được gọi là phản ứng trung hòa.
4. Axit tác dụng với oxit bazơ: Axit + oxit bazơ → muối + H2O
Ví dụ:
6HCl + Fe2O3 → FeCl3 + 3H2O
H2SO4 + MgO → MgSO4 + H2O
Ngoài ra, axit còn tác dụng với muối.
Ví dụ:
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O
II. Axit mạnh và axit yếu
Dựa vào tính chất hóa học, axit được phân làm 2 loại:
+ Axit mạnh như HCl, H2SO4, HNO3,…
+ Axit yếu như H2S, H2CO3,…

