Lý thuyết Hóa học 9 Bài 8: Một số bazơ quan trọng hay, chi tiết
Lý thuyết Hóa học 9 Bài 8: Một số bazơ quan trọng hay, chi tiết
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Hóa học 9 Bài 8: Một số bazơ quan trọng hay, chi tiết nhất sẽ tóm tắt kiến thức trọng tâm bài học từ đó giúp học sinh ôn tập để nắm vững kiến thức môn Hóa 9.

I. NATRI HIĐROXIT (công thức hóa học NaOH)
1. Tính chất vật lí
- Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn, làm bục vải giấy và ăn mòn da. Khi sử dụng NaOH phải hết sức cẩn thận!
2. Tính chất hóa học
Natri hiđroxit có đầy đủ tính chất của một bazơ tan (kiềm).
a. Làm đổi màu chất chỉ thị.
Dung dịch NaOH làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.

b. Tác dụng với axit tạo thành muối và nước (phản ứng trung hòa)
Ví dụ:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
c. Tác dụng với oxit axit tạo thành muối và nước
Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
Chú ý: Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư + Na2CO3 + H2O → 2NaHCO3
SO2 dư + Na2SO3 + H2O → 2NaHSO3
d. Tác dụng với dung dịch muối.
Dung dịch NaOH có thể tác dụng được với nhiều dung dịch muối.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
3. Ứng dụng
Natri hiđroxit có nhiều ứng dụng trong đời sống và trong công nghiệp. Nó được dùng trong:
- Sản xuất xà phòng, chất tẩy rửa, bột giặt.
- Sản xuất giấy, tơ nhân tạo, trong chế biến dầu mỏ.
- Sản xuất nhôm (làm sạch quặng nhôm trước khi sản xuất).
- Chế biến dầu mỏ và nhiều ngành công nghiệp hóa chất khác.
4. Sản xuất natri hiđroxit
Trong công nghiệp, NaOH được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa. Thùng điện phân có màng ngăn giữa cực âm và cực dương.
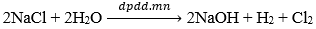
II. CANXI HIĐROXIT (công thức hóa học Ca(OH)2)
Dung dịch canxi hiđroxit có tên thông thường là nước vôi trong.
1. Tính chất hóa học Ca(OH)2
Dung dịch Ca(OH)2 có tính chất hóa học của một bazơ tan.
a) Làm đổi màu chất chỉ thị
Dung dịch Ca(OH)2 làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b) Tác dụng với axit
Ca(OH)2 tác dụng với axit, sản phẩm là muối và nước (phản ứng trung hòa)
Ví dụ:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + H2O
c) Tác dụng với oxit axit
Dung dịch Ca(OH)2 tác dụng với oxit axit sản phẩm là muối và nước
Ví dụ:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Chú ý: Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư + CaCO3 + H2O → Ca(HCO3)2
SO2 dư + CaSO3 + H2O → Ca(HSO3)2
Ngoài ra dung dịch canxi hiđroxit còn tác dụng được với nhiều dung dịch muối.
2. Ứng dụng
Canxi hiđroxit có nhiều ứng dụng. Nó được dùng để:
- Làm vật liệu trong xây dựng.
- Khử chua đất trồng trọt.
- Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật…
III. Thang PH
Thang pH để biểu thị độ axit, độ bazơ của dung dịch:
- Nếu pH = 7: Dung dịch là trung tính.
Ví dụ: nước cất có pH = 7.
- Nếu pH < 7: Dung dịch có tính axit. pH càng nhỏ độ axit của dung dịch càng lớn.
- Nếu pH > 7: Dung dịch có tính bazơ, pH càng lớn độ bazơ của dung dịch càng lớn.
Bài giảng: Bài 8: Một số bazơ quan trọng (Phần B: Ca(OH)2) - Cô Phạm Thu Huyền (Giáo viên VietJack)

