Lý thuyết KHTN 7 Cánh diều Bài 1: Nguyên tử
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 1: Nguyên tử sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Lý thuyết KHTN 7 Cánh diều Bài 1: Nguyên tử
Chỉ từ 150k mua trọn bộ lý thuyết KHTN 7 Cánh diều (cả năm) bản word trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. Nguyên tử là gì?
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Ví dụ:
- Đồng tiền vàng được cấu tạo từ nguyên tử vàng (gold)
- Khí oxygen được cấu tạo từ nguyên tử oxygen
- Nước được tạo nên từ các nguyên tử hydrogen và oxygen.
II. Cấu tạo nguyên tử
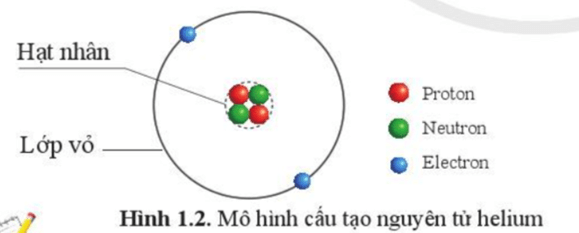
Nguyên tử được coi như một quả cầu, gồm hạt nhân nguyên tử và vỏ nguyên tử
Vỏ nguyên tử |
Hạt nhân |
||
Loại hạt |
Electron |
Proton |
Neutron |
Kí hiệu |
e |
p |
n |
Điện tích |
-1 |
+1 |
0 |
Đặc điểm |
Chuyển động xung quanh hạt nhân |
Nằm ở tâm và có kích thước rất nhỏ so với kích thước của nguyên tử. |
|
Ví dụ: Nguyên tử helium gồm hạt nhân có 2 proton, 2 neutron và vỏ nguyên tử có 2 electron.
Lưu ý:
- Điện tích của hạt nhân nguyên tử bằng tổng điện tích của các proton.
- Số đơn vị điện tích hạt nhân bằng số proton.
Ví dụ:
Nguyên tử nitrogen có 7 proton
⇒ Điện tích hạt nhân là +7. Số đơn vị điện tích hạt nhân là 7.
- Trong nguyên tử, số electron bằng số proton.
III. Sự chuyển động của electron trong nguyên tử
- Theo mô hình của Rơ – dơ – pho – Bo (Rutherford – Bohr), trong nguyên tử, các electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân, như các hành tinh quay quanh Mặt Trời.
- Sự sắp xếp các electron trong nguyên tử:
+ Trong nguyên tử, các electron được xếp thành từng lớp.
+ Các electron được sắp xếp lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài.
+ Mỗi lớp có số electron tối đa xác định. Lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron
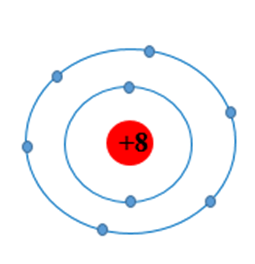
Ví dụ: Nguyên tử oxygen có 8 electron, được phân bố thành hai lớp electron
Lớp thứ nhất có 2 electron
Lớp thứ hai có 6 electron
Mô hình cấu tạo nguyên tử oxygen
IV. Khối lượng của nguyên tử
- Khối lượng của electron (là 0,00055 amu) nhỏ hơn nhiều lần so với khối lượng của proton (xấp xỉ 1 amu) và neutron (xấp xỉ 1 amu) nên coi khối lượng nguyên tử bằng khối lượng hạt nhân.
⇒ Khối lượng của một nguyên tử được coi bằng tổng khối lượng của proton và neutron có trong nguyên tử.
- Khối lượng của nguyên tử được tính bằng đơn vị khối lượng nguyên tử, kí hiệu là amu (atomic mass unit).
1 amu = 1,6605.10-24 g.
Ví dụ:
- Trong nguyên tử carbon có 6 proton; 6 neutron nên khối lượng của một nguyên tử carbon là: 6.1 + 6.1 = 12 (amu)
- Trong nguyên tử nhôm có 13 proton; 14 neutron nên khối lượng của một nguyên tử nhôm là: 13.1 + 14.1 = 27 (amu)