Lý thuyết KHTN 7 Cánh diều Bài 5: Giới thiệu về liên kết hóa học
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Lý thuyết KHTN 7 Cánh diều Bài 5: Giới thiệu về liên kết hóa học
Chỉ từ 150k mua trọn bộ lý thuyết KHTN 7 Cánh diều (cả năm) bản word trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
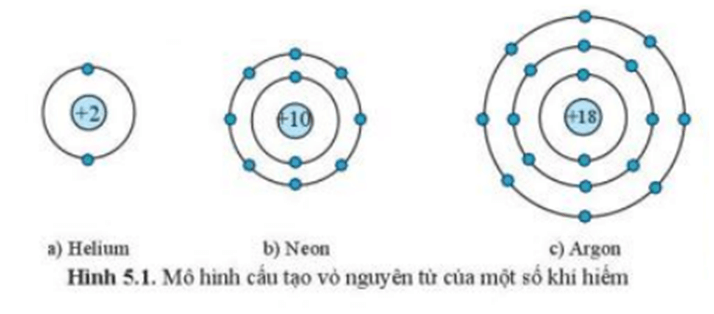
I. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
- Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững.
- Các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
- Nguyên tử nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
II. Liên kết ion
- Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm.
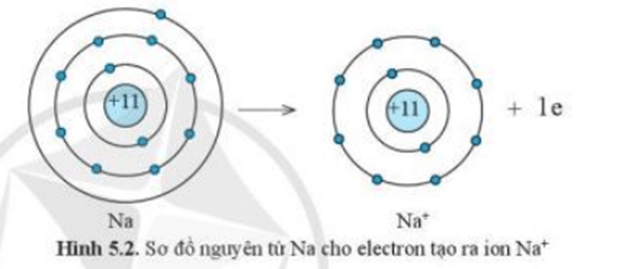
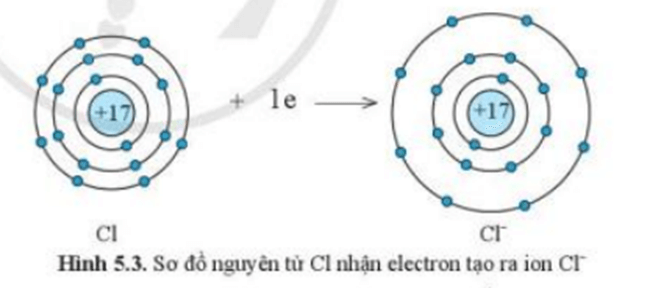
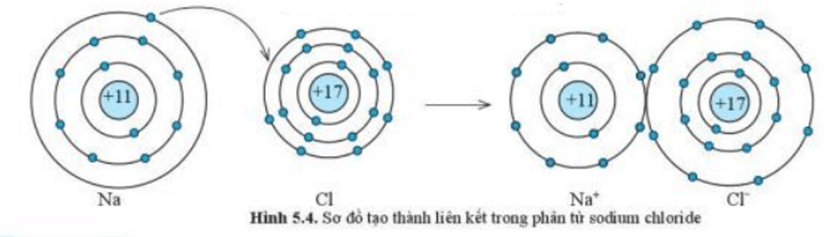
Ví dụ 1:Sự tạo thành liên kết trong phân tử sodium chloride
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+
+ Nguyên tử Cl nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-
+ Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử sodium chloride (NaCl)
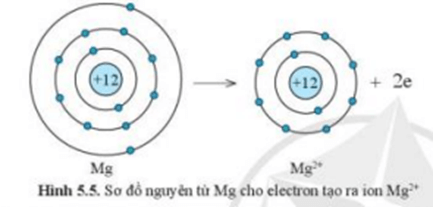
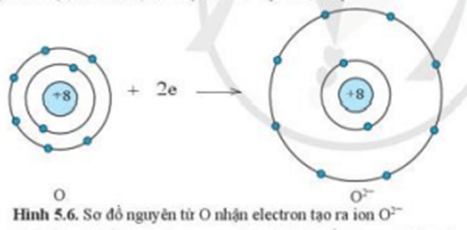
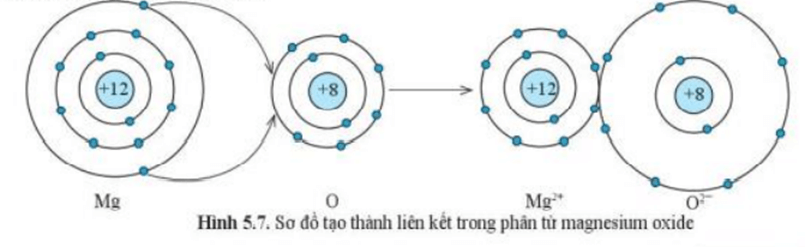
Ví dụ 2:Sự tạo thành liên kết trong phân tử magnesium oxide
+ Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Mg2+
+ Nguyên tử O nhận 2 electron từ nguyên tử Mg trở thành ion mang điện tích âm, kí hiệu là O2-
+ Các ion Mg2+ và O2- hút nhau tạo thành liên kết trong phân tử magnesium oxide (MgO).
- Chất được tạo thành bởi các ion dương và ion âm được gọi là hợp chất ion.
- Các hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường.
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
+ Khi tan trong nước tạo ra dung dịch dẫn được điện.
III. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
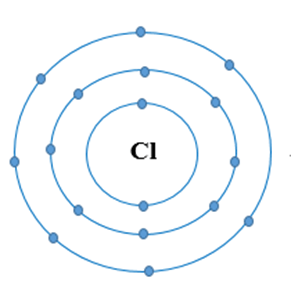
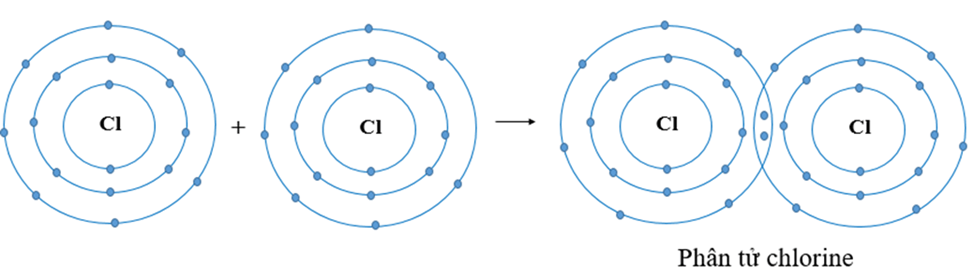
Ví dụ 1:Sự tạo thành liên kết trong phân tử chlorine
+ Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
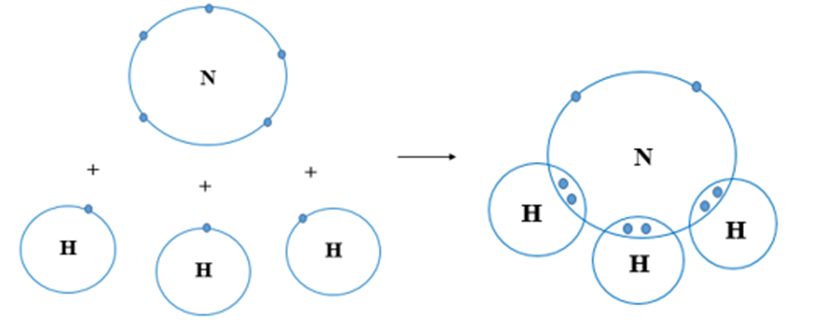
Ví dụ 2:Sự tạo thành liên kết trong phân tử amomonia
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi N kết hợp với H, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
Chú ý: Trong mô hình cấu tạo vỏ nguyên tử ở các phần liên kết cộng hóa trị, chỉ cần biểu diễn lớp electron ngoài cùng.
- Chất được tạo thành nhờ liên kết công hóa trị giữa các nguyên tử được gọi là chất cộng hóa trị.
- Tính chất của chất cộng hóa trị:
+ Trong điều kiện thường, các chất cộng hóa trị có ở cả ba thể:
Rắn (đường ăn, iodine,...)
Lỏng (bromine, ethanol,...)
Khí (oxygen, carbon dioxide,...)
+ Nhiệt độ sôi và nhiệt độ nóng chảy thấp.
+ Nhiều chất cộng hóa trị không dẫn điện (đường ăn, ethanol,...)
Ví dụ: Đường ăn là hợp chất cộng hóa trị nên dễ dàng bị nóng chảy khi đun nóng.
Bảng so sánh một số tính chất của chất ion với chất cộng hóa trị
Tính chất |
Chất ion |
Chất cộng hóa trị |
Trạng thái (ở điều kiện thường) |
Thể rắn |
Cả ba thể (rắn, lỏng, khí) |
Nhiệt độ sôi, nhiệt độ nóng chảy |
Cao |
Thấp |
Dẫn điện |
Tan trong nước tạo dung dịch dẫn được điện |
Nhiều chất không dẫn điện (đường ăn, ethanol,…) |