Lý thuyết KHTN 7 Cánh diều Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Haylamdo biên soạn và sưu tầm tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Lý thuyết KHTN 7 Cánh diều Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Chỉ từ 150k mua trọn bộ lý thuyết KHTN 7 Cánh diều (cả năm) bản word trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
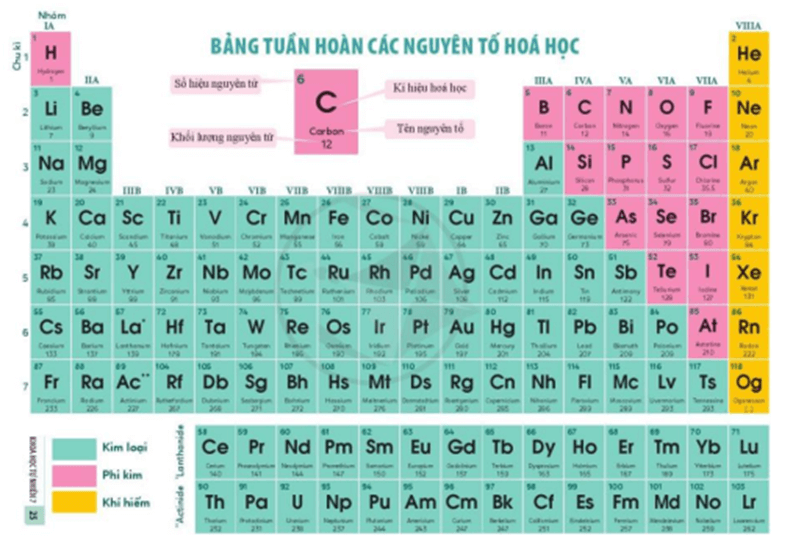
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử
II. Cấu tạo bảng tuần hoàn
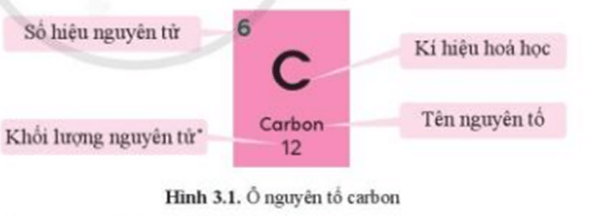
1. Ô nguyên tố
Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (Z)
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử.
Chú ý:
Số hiệu nguyên tử (Z) = số đơn vị điện tích hạt nhân = số proton = số electron = số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Ô nguyên tố carbon cho biết:
+ Số hiệu nguyên tử Z = 6
+ Kí hiệu hóa học: C
+ Tên nguyên tố: carbon
+ Khối lượng nguyên tử: 12 amu
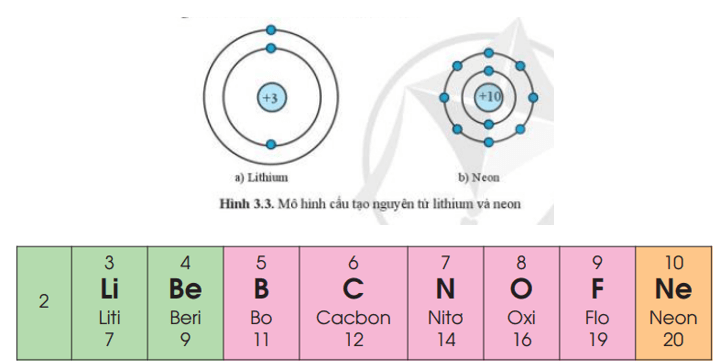
2. Chu kì
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được sắp xếp thành hành theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự chu kì = số lớp electron nguyên tử.
- Bảng tuần hoàn gồm 7 chu kì được đánh số từ 1 đến 7.
- Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân: mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình và kết thúc chu kì là một khí hiếm.
Ví dụ: Chu kì 2 gồm 8 nguyên tố từ Li đến Ne. Nguyên tử của các nguyên tố này có 2 lớp electron. Điện tích hạt nhân tăng dần từ Li là +3 đến Ne là +10.
Đầu chu kì 2 là kim loại điển hình Li, cuối chu kì là phi kim điển hình F, kết thúc chu kì là khí hiếm Ne.
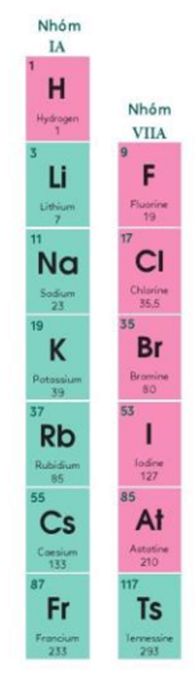
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự nhóm A = số electron lớp ngoài cùng trong nguyên tử.
- Bảng tuần hoàn gồm 18 cột, trong đó có 8 cột là nhóm A (được đánh số La Mã lần lượt từ nhóm IA đến VIIIA) và 10 cột là nhóm B (còn gọi là nhóm các nguyên tố kim loại chuyển tiếp)
Ví dụ: Nhóm IA gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H). Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân của các nguyên tử kim loại trong nhóm IA tăng dần từ Li (+3) đến Fr (+87).
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
Các nguyên tố hóa học được chia làm 3 loại: kim loại, phi kim, khí hiếm.
1. Các nguyên tố kim loại
- Hơn 80% các nguyên tố trong bảng tuần hoàn là kim loại.
- Chúng nằm ở phía bên phải và góc dưới bên phải của bảng tuần hoàn (ô nguyên tố màu xanh).
- Các nguyên tố nhóm IA (trừ hydrogen) đều là kim loại điển hình (kim loại hoạt động mạnh).
2. Các nguyên tố phi kim
- Nằm ở phía trên, bên phải của bảng tuần hoàn (ô nguyên tố màu hồng).
- Các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố nhóm VIIA hầu hết là những phi kim điển hình, fluorine ở đầu nhóm là phi kim hoạt động mạnh nhất.
3. Các nguyên tố khí hiếm
Tất cả các nguyên tố nằm trong nhóm VIIIA được gọi là nguyên tố khí hiếm.
IV. Ý nghĩa của bảng tuần hoàn
Sử dụng bảng tuần hoàn ta có thể biết các thông tin của một nguyên tố hóa học:
- Tên nguyên tố
- Số hiệu nguyên tử
- Kí hiệu hóa học
- Khối lượng nguyên tử
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm).
- Nhận ra được tính chất hóa học đặc trưng của nguyên tố (tính kim loại, phi kim, khí hiếm).
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố ở nhóm VIIIA là khí hiếm.
Ví dụ: Sử dụng bảng tuần hoàn ta biết được các thông tin về nguyên tố lưu huỳnh:
- Tên nguyên tố: sulfur (lưu huỳnh)
- Số hiệu nguyên tử: 16
- Kí hiệu hóa học: S
- Khối lượng nguyên tử: 32 amu.
- Vị trí: Thuộc ô số 16, chu kì 3, nhóm VIA.
- Lưu huỳnh là nguyên tố phi kim.