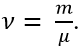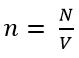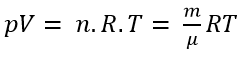Tổng hợp lý thuyết chương Chất khí hay, chi tiết nhất - Vật Lí lớp 10
Tổng hợp lý thuyết chương Chất khí hay, chi tiết nhất
Tài liệu Tổng hợp lý thuyết chương Chất khí hay, chi tiết nhất Vật Lí lớp 10 sẽ tóm tắt kiến thức trọng tâm về chương Chất khí từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Vật Lí lớp 10.

I. Cấu tạo chất khí:
1. Cấu trúc và tính chất của chất khí :
- Mỗi chất khí được tạo thành từ các phân tử giống hệt nhau. Mỗi phân tử có thể có một hoặc nhiều nguyên tử.
- Khi đựng trong bình kín, chất khí chiếm toàn bộ dung tích của bình chứa – ta nói chất khí có tính bành trướng.
- Chất khí dễ nén, khi tăng áp suất tác dụng lên một lượng khí thì thể tích chất khí giảm đi đáng kể.
- Chất khí có khối lượng riêng nhỏ hơn chất rắn và chất lỏng.
2. Lượng chất và mol:
- Lượng chất chứa trong một vật được xác định theo số phân tử hay nguyên tử chứa trong chất ấy.
- Lượng chất đo bằng mol: 1 mol là lượng chất trong đó số phân tử hay nguyên tử bằng số nguyên tử chứa trong 12g cacbon 12.
- Số Avôgađrô : NA = 6,02.1023 mol-1.
- Khối lượng mol kí hiệu là : (đọc là muy). Ở đktc 1mol (to = 0oC và po = 1atm) thể tích 1 mol khí bất kì đều bằng V0 = 22,4 l/mol.
- Khối lượng 1 phân tử khí: 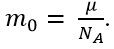
- Số mol chứa trong khối lượng m của một chất:
- Số phân tử hay nguyên tử chứa trong khối lượng m của một chất: 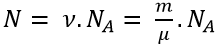
- Mật độ phân tử khí (n) là số phân tử khí có trong một đơn vị thế tích:

3. Thuyết động học phân tử chất khí :
- Chất khí bao gồm các phân tử, kích thước mỗi phân tử rất nhỏ coi như một chất điểm.
- Các phân tử khí chuyển động hỗn loạn không ngừng, chuyển động này phụ thuộc vào nhiệt độ, không có hướng ưu tiên và gọi là chuyển động nhiệt của các phân tử khí.
- Khi chuyển động các phân tử va chạm với nhau và với thành bình … Khi rất nhiều phân tử khí va chạm với thành bình gây ra áp suất chất khí lên thành bình chứa.
4. Cấu tạo phân tử của vật chất :
- Vật chất được cấu tạo từ các phân tử hoặc nguyên tử . Phân tử chuyển động nhiệt không ngừng.
- Ở thể khí các phân tử ở xa nhau, lực tương tác giữa các phân tử rất yếu và do đó chất khí luônchiếm đầy bình chứa, không có hình dạng và thể tích xác định.
- Ở thể rắn và thể lỏng các phân tử được xắp xếp gần nhau và theo một trật tự nhất định, lực liên kết giữa các phân tử lớn hơn chất khí vì vậy ở thể rắn và thề lỏng vật chất có thể tích xác định, nhưng chất lỏng chưa có hình dạng ổn định như chất rắn.
II. Quá trình đẳng nhiệt – Định luật Bôi lơ – Mariot:
- Nhiệt độ tuyệt đối (K): T = t + 273
- Nội dung định luật: Trong quá trình đẳng nhiệt của một
lượng khí nhất định, áp suất tỉ lệ nghịch với thể tích.
- Biểu thức định luật: p.V = hằng số
Xét ở hai trạng thái (1) và (2) , ta có biểu thức: p1V1 = p2V2 .
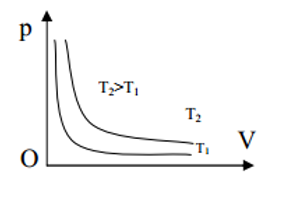
- Đường đẳng nhiệt:
Đường đẳng nhiệt là đổ thị biểu diễn quan hệ giữa áp suất p và thể tích V của một lượng khí xác định ở nhiệt độ không đổi. Trong hệ tọa độ p – V đường đẳng nhiệt là đường hyperbol.
III. Quá trình đẳng tích – Định luật Sác – lơ:
- Nội dung định luật: Trong quá trình đẳng tích của một lượng khí nhất định, áp suất tỉ lệ thuận với nhiệt độ tuyệt đối.
- Biểu thức: 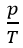
Xét ở 2 trạng thái (1) và (2), ta có biểu thức: 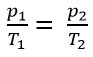
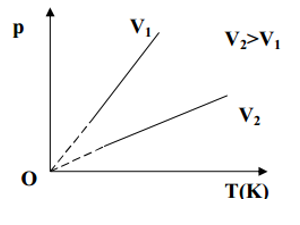
- Đường đẳng tích:
Trong hệ tọa độ (p,T) đường đẳng tích là đường thẳng mà nếu kéo dài sẽ đi qua gốc tọa độ.
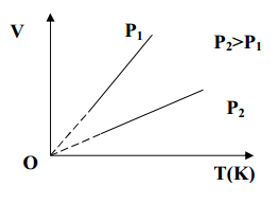
IV. Quá trình đẳng áp – Định luật Gay – Luyxac:
- Nội dung định luật: Trong quá trình đẳng áp của một lượng khí nhất định, thể tích tỉ lệ thuận với nhiệt đọ tuyệt đối.
- Biểu thức định luật: 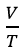
Xét ở hai trạng thái (1) và (2): 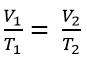
- Đường đẳng áp:
Đường đẳng áp là đồ thị biểu diễn quan hệ giữa thể tích và nhiệt độ của một lượng khí xác định ở áp suất không đổi.
V. Phương trình trạng thái của khí lí tưởng. Phương trình Claperon – Mendeleev:
1. Khí thực và khí lí tưởng:
- Các khí thực chỉ tuân theo gần đúng các định luật về chất khí.
- Khi ở nhiệt độ thấp, sự khác biệt giữa khí thực và khí lí tưởng không quá lớn nên ta có thể áp dụng các định luật về chất khí.

2. Phương tình trạng thái của khí lí tưởng:
- Phương tình trạng thái của khí lí tưởng: là phương tình biểu thị mối quan hệ giữa 3 thông số trạng thái (p, V, T) của một khối lượng khí xác định.
- Phương trình: 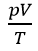
- Xét ở 2 trạng thái (1) và (2): 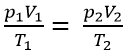
3. Phương trình Claperon – Mendeleev:
- Phương trình Claperon, Medeleev: là phương trình biểu thị mối quan hệ giữa 3 thông số trạng thái (p, V, T) và khối lượng (hoặc số mol) của một lượng khí.
- Phương trình:
Trong đó:
R là hằng số của khí lí tưởng
R = 8,314 J/mol.K với p (Pa), V (m3).
R = 0,082 L.atm/mol.K với p (atm), V (lít).
μ là khối lượng mol nguyên tử (g).
m là khối lượng nguyên tử (g).
n là số mol.