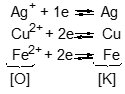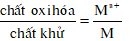Giáo án Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (tiết 3) mới nhất
Giáo án Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (tiết 3) mới nhất
Haylamdo biên soạn và sưu tầm Với mục đích giúp các Thầy / Cô giảng dạy môn Hóa học dễ dàng biên soạn Giáo án Hóa học lớp 12, VietJack biên soạn Giáo án Hóa học 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại (tiết 3) phương pháp mới theo hướng phát triển năng lực theo 5 bước bám sát mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu Giáo án Hóa học 12 này sẽ được Thầy/Cô đón nhận và đóng góp những ý kiến quí báu.
A. CHUẨN KIẾN THỨC – KĨ NĂNG
I. KIẾN THỨC – KĨ NĂNG
1. Kiến thức
Hiểu được:
- Quy luật sắp xếp trong dãy điện hoá các kim loại (các nguyên tử được sắp xếp theo chiều giảm dần tính khử, các ion kim loại được sắp xếp theo chiều tăng dần tính oxi hoá) và ý nghĩa của nó.
2. Kỹ năng
- Dự đoán được chiều phản ứng oxi hoá - khử dựa vào dãy điện hoá.
- Viết được các PTHH của phản ứng oxi hoá - khử để chứng minh tính chất của kim loại.
- Tính % khối lượng kim loại trong hỗn hợp.
3. Trọng tâm
- Dãy điện hoá của kim loại và ý nghĩa của nó.
4. Tư tưởng: Tích cực, chủ động trong học tập
II. PHÁT TRIỂN NĂNG LỰC
1. Phát triển năng lực
* Các năng lực chung
1. Năng lực tự học
2. Năng lực hợp tác
3. Năng lực phát hiện và giải quyết vấn đề
4. Năng lực giao tiếp
* Các năng lực chuyên biệt
1. Năng lực sử dung ngôn ngữ
2. Năng lực tính toán
3. Năng lực vận dụng kiến thức hóa học vào cuộc sống
2. Phát triển phẩm chất
- Trung thực, tự trọng, chí công, vô tư;
- Tự lập, tự tin, tự chủ; Có trách nhiệm với bản thân, cộng đồng, đất nước, nhân loại
B. CHUẨN BỊ
1. Giáo viên: Máy chiếu hoặc tranh vẽ, các đồ dùng thí nghiệm và hóa chất liên quan
2. Học sinh: Đọc và làm bài trước khi đến lớp
C. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC:
- Thuyết trình nêu vấn đề;
- Vấn đáp tìm tòi;
- Dạy học hợp tác.
D. TIẾN TRÌNH BÀI DẠY
1. Hoạt động khởi động
1.1. Ổn định tổ chức
1.2. Kiểm tra bài cũ:
Hoàn thành các PTHH dạng phân tử và ion rút gọn của phản ứng sau:
Cu + dd AgNO3 →
Fe + CuSO4 →
Cho biết vai trò của các chất trong phản ứng.
2. Hoạt động hình thành kiến mới
Hoạt động của giáo viên |
Hoạt động của Học sinh – Phát triển năng lực |
Nội dung |
|
* Hoạt động 1: GV yêu cầu HS: - Viết các quá trình oxi hóa và quá trình khử của mỗi phản ứng trong mục kiểm tra bài cũ - GV gợi ý: Xét một sơ đồ ta thấy tồn tại cả chất oxi hóa và chất khử (có cùng nguyên tố không?) - Mỗi chất oxi hoá và chất khử của cùng một nguyên tố tạo nên cặp oxi hoá - khử Mn+ + ne chất oxi hoá M là chất khử, ion Mn+ là chất oxi hóa. - GV: từ 2 vd trên có thể có các cặp oxi hóa - khử nào? - GV lưu ý cách viết cặp oxi hóa-khử. |
HS viết quá trình oxi hóa và quá trình khử Phát triển năng lực sử dụng ngôn ngữ hóa học, phát hiện và giải quyết vấn đề |
III – ĐÃY ĐIỆN HOÁ CỦA KIM LOẠI 1. Cặp oxi hoá – khử của kim loại Kết luận: Mn+ + ne (chất oxi hoá) Chất oxi hoá (Mn+) và chất khử (M) của cùng một nguyên tố tạo nên cặp oxi hoá - khử Ký hiệu: Thí dụ: Cặp oxi hóa – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe |
|
* Hoạt động 2: GV: Cho các nguyên tử và ion sau: Mg, Fe, Cu, Ag, H2, Mg2+, Fe2+, Cu2+, Ag+, H+. Yêu cầu: hãy viết PTHH dạng ion cho các phản ứng có thể xảy ra giữa các chất trên? * Nhận xét: Mg có 4 phản ứng, Fe có 3 phản ứng, Cu chỉ có 1 phản ứng, Ag không có phản ứng nào? * GV: Có phản ứng: Cu + H+ → không? Cu + Fe2+ → không? |
HS: Viết các phương trình xảy ra - HS trả lời Phát triển năng lực tự học, phát hiện và giải quyết vấn đề |
2. So sánh tính chất của các cặp oxi hoá – khử Phản ứng có thể xảy ra: Mg + Fe2+ → Mg2+ + Fe Mg + Cu2+ → Mg2+ + Cu Mg + 2H+ → Mg2+ + H2 Mg + 2Ag+ → Mg2+ + 2Ag Fe + Cu2+ → Fe2+ + Cu Fe + 2H+ → Fe2+ + H2 Fe + 2Ag+ → Fe2+ + 2Ag Cu + 2Ag+ → Cu2+ + 2Ag ⇒ Tính khử của: Mg > Fe > Cu > Ag |
..........................................
Tài liệu còn nhiều, mời bạn tải xuống để xem đầy đủ!

 M
M