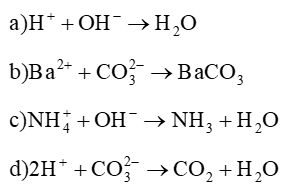107 bài tập trắc nghiệm tổng hợp Hóa học năm 2024 có đáp án (Phần 5)
Haylamdo biên soạn và sưu tầm 107 câu trắc nghiệm tổng hợp Hóa học có lời giải chi tiết giúp học sinh lớp 12 biết cách làm bài tập & ôn luyện trắc nghiệm môn Hóa học.
107 bài tập trắc nghiệm tổng hợp Hóa học năm 2024 có đáp án (Phần 5)
Câu 1:
Trình bày phương pháp hoá học phân biệt các lọ hoá chất mất nhãn sau: K2SO4, KCl, KOH, H2SO4?
Câu 2:
Cho 2,11 gam hỗn hợp Al, Zn tác dụng vừa đủ với 200 gam dung dịch HCl thu được dung dịch X và 1,456 lít khí (đktc).
a. Tính thành phần phần trăm về số mol và khối lượng của mỗi kim loại trong hỗn hợp trên?
b. Tính nồng độ % của dung dịch HCl đã dùng?
c. Tính nồng độ % của các chất trong dung dịch X?
d. Tính nồng độ mol của các chất trong dung dịch X biết khối lượng riêng của dung dịch X là 1,4g/ml.
Câu 3:
Cho cấu hình của Zn2+ là [Ar]3d10. Vị trí của Zn trong bảng tuần hoàn là
Câu 4:
Nguyên tử của nguyên tố X là nguyên tố d thuộc chu kì 4, nhóm IIB. Cấu hình electron của nguyên tử X là
Câu 5:
Cho dung dịch Ba(OH)2 đến dư vào 75 ml dung dịch muối amoni sunfat.
1. Viết phương trình hoá học của phản ứng dưới dạng ion.
Câu 6:
2. Tính nồng độ mol của các ion trong dung dịch muối ban đầu, biết rằng phản ứng tạo ra 17,475 g một chất kết tủa. Bỏ qua sự thuỷ phân của ion amoni trong dung dịch.
Câu 7:
Có hỗn hợp khí gồm CO và CO2. Nếu cho hỗn hợp này tác dụng với dung dịch Ca(OH)2 dư, sinh ra 1 gam kết tủa trắng. Nếu cho hỗn hợp này tác dụng với CuO dư, nung nóng, thu được 0,64 gam kim loại màu đỏ.
a) Viết các phương trình hóa học.
Câu 9:
Cho 3,2 gam SO2 qua 80 gam dung dịch Ca(OH)2 3,7% được dung dịch A. Trong dung dịch A có những chất nào? Tính C% của chất tan trong dung dịch A.
Câu 10:
Hợp chất X là 1 amin đơn chức bậc 1 chứa 31,11% nitơ. Công thức phân tử của X là:
Câu 11:
Trộn 30 ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7 gam AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
Câu 12:
Cho khối lượng nguyên tử của đồng là 64u.
a. Tính khối lượng tuyệt đối của đồng bằng gam.
b. Tính số nguyên tử đồng có trong 2,88 kg đồng.
(cho biết 1 mol nguyên tử chứa 6,02.1023 nguyên tử)
Câu 13:
1) Tính khối lượng riêng g/c của nguyên tử H. Biết bán kính của nguyên tử H r = 0,53 Å và khối lượng của H = 1,0079 gam
2) Giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3. Tính khối lượng riêng của hạt nhân.
Câu 14:
Cho 68,7g hỗn hợp gồm Al, Fe và Cu tan hết trong dd HNO3 đặc nguội, sau phản ứng thu được 26,88 lít khí NO2 (đktc) và m gam rắn B không tan. Tìm giá trị của m?
Câu 15:
Câu 16:
Cho 9 lít N2 và 6 lít H2 vào bình tổng hợp NH3. Tính thành phần % theo thể tích của các khí có trong hỗn hợp sau phản ứng và hiệu suất phản ứng trong 2 trường hợp sau (các điều kiện nhiệt độ không đổi, có chất xúc tác thích hợp, thể tích các khí đo ở cùng điều kiện):
a. Hỗn hợp sau phản ứng có thể tích bằng 14 lít
b. Thể tích của khí NH3 trong hỗn hợp sau phản ứng chiếm 20% toàn bộ thể tích của hỗn hợp này.
Câu 17:
Viết phương trình ion thu gọn của phương trình:
Ca(OH)2 + (NH4)2CO3 → 2NH3 + CaCO3 + 2H2O
Câu 18:
Sục 3,36 lít khí CO2 (đktc) vào 200 ml dung dịch NaOH 1M. Tổng khối lượng muối thu được sau phản ứng là:
Câu 19:
Lên men m gam glucozơ với hiệu suất 90%, lượng khí CO2 sinh ra hấp thụ hết vào dung dịch nước vôi trong, thu được 10 gam kết tủa. Khối lượng dung dịch sau phản ứng giảm 3,4 gam so với khối lượng dung dịch nước vôi trong ban đầu. Giá trị của m là:
B. 30,0;
Câu 20:
Cho m gam hỗn hợp gồm Al và Fe tác dụng với dung dịch HNO3 loãng dư thu được 2,24 lít (ở đkc) khí NO duy nhất. Mặt khác, cũng lượng hỗn hợp trên cho tác dụng với dung dịch HCl thu được 2,8 lít khí hiđro ở đkc. Giá trị của m là:
Câu 21:
Tính thể tích khí N2 và khí H2 (đktc) cần dùng để điều chế được 17 gam NH3. Biết hiệu suất phản ứng là 25%.
Câu 22:
Tổng số hạt mang điện trong ion là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện tích dương trong nguyên tử B là 22. Tính số hiệu của từng nguyên tử.
Câu 24:
Nguyên tử P có hoá trị V trong hợp chất nào sau đây?
A. P2O3;
C. P4O4;
D. P4O10.
C. P4O4;
Câu 25:
Nung 20 gam CaCO3 đến khi phản ứng xảy ra hoàn toàn, sau đó hấp thụ toàn bộ khí CO2 sinh ra 0,5 lít dung dịch Ca(OH)2 0,2 M. Tính nồng độ mol muối thu được (Coi thể tích thay đổi không đáng kể).
Câu 26:
Viết các phương trình hóa học:
a) Điều chế CuSO4 từ Cu.
b) Điều chế MgCl2 từ mỗi chất sau: Mg, MgSO4, MgO, MgCO3.
(Các hóa chất cần thiết coi như có đủ).
Câu 27:
Cân 1 kg gạo với 2 kg nước rồi cho vào nồi nặng 0,5 kg sau khi cơm chín đen nồi đi cân nặng 3,5 kg
a) Định luật bảo toàn khối lượng có áp dụng cho trường hợp này ko?
b) Giả sử tiếp tục đun cơm bốc hơi thu được 0,2 kg hơi tính khối lượng nồi cơm trong trường hợp trên.
Câu 28:
Trộn 3 dung dịch HCl 0,3M; H2SO4 0,2M; và H3PO4 0,1M với những thể tích bằng nhau thu được dung dịch X. Để trung hòa 300 ml dung dịch X cần vừa đủ V ml dung dịch Y gồm NaOH 0,2M và Ba(OH)2 0,1M. Giá trị của V là:
Câu 29:
Cho dung dịch Ba(OH)2 đến dư vào 100ml dung dịch X có chứa các ion: , , thì có 23,3 gam một kết tủa được tạo thành và đun nóng thì chỉ có 6,72 lít (đktc) một chất khí thoát ra. Nồng độ mol của (NH4)2SO4 và NH4NO3 trong dung dịch X là bao nhiêu?
Câu 30:
Một nguyên tố có 3 đồng vị mà số khối là 3 số liên tiếp có tổng là 51, đồng vị nhẹ nhất có số p bằng số n. Hỏi số hạt n trong đồng vị nặng nhất là bao nhiêu?
Câu 31:
Viết phương trình phân tử, phương trình ion đầy đủ, phương trình ion thu gọn của phản ứng BaCl2 tác dụng với H2SO4?
Câu 32:
Trong phân tử HNO3 tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là: (Cho )
Câu 33:
Hỗn hợp X gồm Fe, Zn, ZnO và FeO. Để hoà tan 12,46 gam hỗn hợp X cần 380 ml dung dịch HCl 1M thu được 2,464 lít khí H2 (đktc). Cho 12,46 gam hỗn hợp X tác dụng với dung dịch HNO3 dư thu được 1,568 lít NO (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 44,2 gam muối khan. Số mol HNO3 tham gia phản ứng là:
Câu 35:
Viết phương trình phân tử, phương trình ion rút gọn cho các phản ứng (nếu có):
a) Fe2(SO4)3 + AlCl3
b) Pb(NO3)2 + H2S
Câu 37:
Ở trạng thái cơ bản, cấu hình electron nguyên tử nào sau đây không đúng?
Câu 38:
Cho 0,06 mol Fe vào dung dịch HNO3. Số mol HNO3 tối thiểu để hoà tan lượng Fe trên là:
Câu 39:
Hòa tan hết 27,6 gam hỗn hợp A gồm R2SO3 và RHSO3 (R là kim loại) bằng H2SO4 đặc nóng dư. Sau phản ứng hoàn toàn được tối đa V lít SO2 (đktc) duy nhất và dd X. Hấp thụ hết V lít SO2 trên vào 200 ml dd NaOH 1,5 M và KOH 0,5 M. Sau phản ứng được 30,08 gam chất tan. Mặt khác 11,5 gam kim loại trên tác dụng với 400 ml dd HCl 1M được dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư được m gam kết tủa. Tính m, V và xác định R.
Câu 41:
Đổ 2 ml dung dịch axit HNO3 63% (d = 1,43 g/ml) vào nước thu được 2 lít dung dịch. Tính nồng độ H+ của dung dịch thu được:
Câu 42:
Trong phương trình phản ứng:
K2SO3 + KMnO4 + KHSO4 → K2SO4 + MnSO4 + H2O
Tổng hệ số nguyên tối giản sau khi cân bằng của các chất tham gia phản ứng là:
Câu 43:
Phản ứng nào dưới đây cho thấy NO2 vừa là chất khử, vừa là chất oxi hoá?
Câu 44:
Cho các phản ứng sau:
H2S + O2 dư → Khí X + H2O
Khí Y + H2O
NH4HCO3 + HClloãng → Khí Z + NH4Cl + H2O
Các khí X, Y, Z thu được lần lượt là:
Câu 46:
Cho V lít CO2 ( đktc) tác dụng 500ml dung dịch Ca(OH)2 0,5M tạo thành 10 gam kết tủa. Tính giá trị của V?
Câu 48:
Cho 10 gam CaCO3, MgCO3 vào 100ml dung dịch HCl 1,5 M, cho tới khi phản ứng xảy ra xong. Thể tích CO2 (đktc) thoát ra là:
Câu 49:
Nguyên tố kim loại M chiếm 52,94% về khối lượng hợp chất trong oxit cao nhất của nó.
a, Xác định M.
b, Cho 20,4 gam oxit của M tan trong 246,6 gam dung dịch 17,86% của hợp chất hiđro với phi kim X thuộc nhóm VIIA tạo thành dung dịch B. Gọi tên X và tính C% của dung dịch B.
Câu 50:
Đốt cháy hoàn toàn một hidrocacbon A cần dùng 38,4 gam O2 và thu được 16,8 lít CO2 (đktc). Khi cho A tác dụng với Cl2 theo tỉ lệ mol 1:1 thu được sản phẩm thế duy nhất. Xác định công thức phân tử và gọi tên A?
Câu 51:
Cân bằng phương trình hoá học:
a, C3H6 + O2 → CO2 + H2O
b, Al + Fe3O4 → Al2O3 + Fe
Câu 52:
Câu 53:
Anion có số electron là 10, số nơtron là 8 thì nguyên tử khối của X là:
Câu 55:
Cho phản ứng hoá học: A + B → C + D
Biết khối lượng của 3 chất tính được khối lượng của chất còn lại như thế nào?
Viết biểu thức tính khối lượng của chất đó.
Câu 56:
Khi đốt nóng 1 gam magie (Mg) kết hợp được với 2,96 gam clo (Cl) tạo ra hợp chất magie clorua. Tìm công thức hóa học của magie clorua, biết phân tử của hợp chất chỉ có một nguyên tử magie.
Câu 57:
Hợp chất X có phân tử khối bằng 62 đvC. Trong phân tử của hợp chất nguyên tố oxi chiếm 25,8% theo khối lượng, còn lại là nguyên tố Na. Số nguyên tử của nguyên tố O và Na trong phân tử hợp chất là bao nhiêu?
Câu 58:
Cho 1 gam NaOH rắn tác dụng với dung dịch chứa 1 gam HNO3. Dung dịch sau phản ứng có môi trường:
Câu 59:
Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, thu được 15,6 gam kết tủa. Giá trị lớn nhất của V là:
Câu 60:
Cân bằng phương trình hoá học bằng phương pháp thăng bằng electron:
FeS2 + O2 → Fe2O3 + SO2
Câu 61:
Một dung dịch chứa 0,39 gam K+, 0,54 gam Al3+, 1,92 gam và ion Nếu cô cạn dung dịch thì thu được bao nhiêu gam muối khan?
Câu 62:
Tính bán kính nguyên tử (theo nm) của 1 nguyên tử Mg biết nguyên tử khối của Mg là 24,31 và khối lượng riêng là 1,74g/cm3.
Câu 63:
Sục V lít CO2 (đktc) vào dung dịch Ba(OH)2 thu được 9,85 gam kết tủa. Lọc bỏ kết tủa rồi cho dung dịch H2SO4 dư vào nước lọc, thu thêm 1,65 gam kết tủa nữa. Giá trị của V là:
Câu 65:
Trộn V1 lít dung dịch HCl có pH = 1 với V2 lít dung dịch HCl pH = 2 thu được dung dịch HCl có pH = 1,26. Tỉ lệ V2/V1 là bao nhiêu?
Câu 67:
Hoà tan 2,13 gam Al(NO3)3 vào nước được 200 ml dung dịch. Nồng độ của ion trong dung dịch là:
Câu 69:
Cho hỗn hợp gồm 0,1 mol HCl và 0,2 mol H2SO4 vào dung dịch chứa 0,2 mol NaOH và 0,1 mol Ba(OH)2. Hỏi dung dịch sau phản ứng làm quỳ tím chuyển màu gì và khối lượng chất rắn thu được là bao nhiêu?
Câu 70:
Hoà tan 18,4 gam hỗn hợp hai kim loại hoá trị II và III bằng axit HCl thu được dung dịch A + khí B. Chia đôi B:
a, Phần B1 đem đốt cháy thu được 4,5 g H2O. Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khan?
b, Phần B2 tác dụng hết clo và cho sản phẩm hấp thụ vào 200 ml dung dịch NaOH 20% (D = 1,2 g/ml). Tìm % các chất trong dung dịch tạo ra.
c, Tìm 2 kim loại nếu biết tỉ số mol 2 muối khan = 1:1 và khối lượng mol kim loại này gấp 2,4 lần khối lượng mol của kim loại kia.
Câu 71:
Viết phương trình phân tử và phương trình ion rút gọn sau:
Ca(HCO3)2 + NaOH→?
Câu 72:
Cho 6,5 gam kẽm tác dụng vừa đủ với 200 ml dung dịch HCl
a) Tính nồng độ mol dung dịch axit đã tham gia?
b) Tính thể tích khí hiđro thu được (ở đktc)?
Câu 73:
Các cách viết 4 C, 6 Al, 8 Ca lần lượt chỉ ý gì? Hãy dùng chữ số và các kí hiệu hóa học diễn đạt các ý sau: Bốn nguyên tử nitơ, mười hai nguyên tử canxi, sáu nguyên tử natri?
Câu 74:
Tổng số proton, nơtron, electron trong nguyên tử của hai nguyên tố X và Y là 78, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26. Tỉ số hạt mang điện trong X so với trong Y là 10:3. Tìm 2 nguyên tố X và Y.
Câu 75:
Có các chất: CaCO3, H2O, CuSO4, KClO3, FeS2. Hãy viết các phương trình hoá học điều chế các chất sau: Vôi sống, vôi tôi, CuO, CuCl2, CaSO4. Cho biết các điều kiện xảy ra phản ứng và các chất xúc tác cần thiết coi như có đủ.
Câu 77:
Cho 2,24 lít N2 tác dụng với lượng dư H2, sau một thời gian thu được 3,36 lít khí NH3 (các thể tích khí đều đo ở đktc). Tính hiệu suất của phản ứng tổng hợp NH3?
Câu 78:
Cho lượng dư N2 tác dụng với 6,72 lít khí H2 (đktc). Biết hiệu suất của phản ứng là 25%, thu được m (gam) NH3. Giá trị của m?
Câu 79:
Viết phương trình phân tử và ion rút gọn nếu có khi trộn lẫn các chất
a) dd HNO3 và CaCO3
b) dd H2SO4 và NaOH
c) dd KOH và dd FeCl3
d) dd Ca(NO3)2 và Na2CO3
e) dd NaOH và Al(OH)3
f) dd NaOH và Zn(OH)2
g) FeS và dd HCl
h) dd CuSO4 và dd H2S
i) dd NaHCO3 và HCl
j) Ca(HCO3)2 và HCl
Câu 82:
Nhỏ từ từ dung dịch chứa 0,1 mol Na2CO3 và 0,15 mol NaHCO3 vào V lít dung dịch HCl 1M. Sau phản ứng hoàn toàn thoát ra 2,8 lít khí CO2 ở đktc. Giá trị của V là?
Câu 83:
Hoàn thành 5 phương trình theo sơ đồ sau:
A + ? → Na2SO4 + ?
Biết 6 gam A tác dụng với dung dịch BaCl2 dư thu được 11,65 gam kết tủa.
Câu 84:
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X thu được 8,8 gam CO2, 3,6g H2O. Ở đktc một lít hơi X có khối lượng xấp xỉ 3,93g. Tìm công thức phân tử của X?
Câu 86:
V lít khí CO2 (đktc) vào 1,5 lít Ba(OH)2 0,1M được 19,7 gam kết tủa. Giá trị lớn nhất của V là?
Câu 87:
Cân bằng các phản ứng hoá học sau bằng phương pháp thăng bằng electron:
a) H2S + H2SO4 → S + H2O
b) Cu + H2SO4→ CuSO4 + SO2 + H2O
Câu 90:
Lập công thức hóa học và tính phân tử khối của các chất sau:
a) Al và nhóm OH (Al = 27; O = 16; H = 1)
b) Ca và nhóm PO4 (Ca = 40; P = 31; O = 16)
Câu 91:
Oxide cao nhất của một nguyên tố là RO3. Nó có trong thành phần của oleum, được sử dụng trong sản xuất nhiều chất nổ. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng. Xác định nguyên tố R.
Câu 92:
Câu 93:
Khi cho dung dịch H3PO4 tác dụng với dung dịch NaOH tạo được dung dịch M.
a) Hỏi M có thể chứa những muối nào?
b) Phản ứng nào có thể xảy ra khi thêm KOH vào dung dịch M?
c) Phản ứng nào có thể xảy ra khi thêm H3PO4 (hoặc P2O5) vào dung dịch M?
Viết phương trình hoá học (PTHH) của các phản ứng.
Câu 94:
Có 4 lọ bị mất nhãn đựng các chất NaOH, HCl, NaNO3, NaCl. Hãy trình bày phương pháp hóa học để nhận biết 4 dung dịch này.
Câu 95:
Cho 250 ml NaOH 4M vào 50 ml Al2(SO4)3 2M sau phản ứng thu được dung dịch X. Tính khối lượng kết tủa sau phản ứng.
Câu 96:
Cho các phát biểu sau đây:
(a) Ancol có nhiệt độ sôi cao hơn nhiệt độ sôi của anđehit tương ứng.
(b) Dung dịch AgNO3 trong NH3 có thể oxi hóa axetilen tạo kết tủa vàng.
(c) Để trái cây nhanh chín có thể cho tiếp xúc với khí axetilen.
(d) Cho axetilen phàn ứng với nước có xúc tác HgSO4/H2SO4 thu được duy nhất một ancol.
(e) Trùng hợp etilen thu được teflon.
(f) Dung dịch AgNO3 trong NH3 có thể oxi hóa andehit tạo kết tủa trắng, ánh kim.
Trong số các phát biểu trên, số phát biểu không đúng là:
A. 4
B. 2
C. 3
D. 5
Câu 97:
Một hợp chất Y có phân tử khối là 58 đvC, cấu tạo từ 2 nguyên tố C và H trong đó C chiếm 82,76% khối lượng của hợp chất. Công thức phân tử của Y là:
Câu 98:
Biết rằng axit clohiđric có phản ứng với chất canxi cacbonat tạo ra chất canxi clorua, nước và khí cacbon dioxit thoát ra. Một cốc dựng dung dịch axit clohiđric (1) và cục đá (2) (thành phần chính là chất canxi cacbonat) được đặt trên một đĩa cân. Trên đĩa cân thứ hai đặt quả cân (3) vừa đủ cho cân ở vị trí cân bằng.
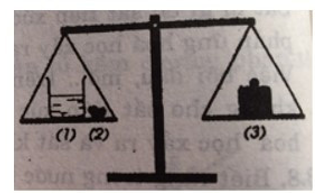
Bỏ cục đá vôi vào dung dịch axit clohidric. Sau một thời gian phản ứng, cân ở vị trí nào: A, B hay C? Giải thích.
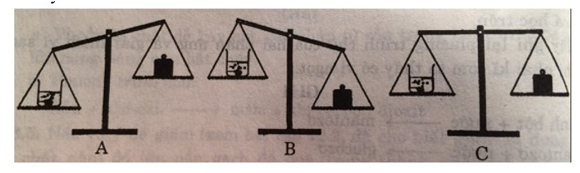
Câu 99:
Thủy phân không hoàn toàn một lượng hexapeptit mạch hở X chỉ thu được hỗn hợp Y gồm Ala-Gl; 2,925 gam Val; 8,6 gam Val-Ala-Val-Gly; 18,375 gam Ala-Val-Gly; 12,25 gyam Ala-Gly-Val. Đốt cháy hoàn toàn hỗn hợp Y cần dùng a mol O2. Giá trị của a là:
Câu 100:
Đun 0,04 mol hỗn hợp gồm hơi nước và khi CO2 qua cacbon nung đỏ, thu được 0,07 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y đi qua 75 ml dung dịch Ca(OH)2 0,1M, thu được m gam kết tủa. Giá trị của m là:
Câu 101:
Có 3 lọ mất nhãn, mỗi lọ đựng 1 trong 3 dung dịch sau: Dung dịch axit, dung dịch bazơ, dung dịch muối. Hãy nêu cách nhận biết mỗi lọ dung dịch bằng phương pháp hoá học?
Câu 102:
Cho các phát biểu sau về anilin:
(a) Anilin là chất lỏng, không màu, rất độc, ít tan trong nước.
(b) Anilin là amin bậc I, có tính bazơ và làm quỳ tím đổi sang màu xanh.
(c) Anilin chuyển sang màu nâu đen khi để lâu trong không khí vì bị oxi hoá bởi oxi không khí.
(d) Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm, polime, dược phẩm,…
Số phát biểu đúng là:
A. 1
B. 3
C. 2
D. 4
Câu 103:
Cho biết 1 nguyên tử Mg có 12e, 12p, 12n.
a) Tính khối lượng 1 nguyên tử Mg?
b) 1 (mol) nguyên tử Mg nặng 24,305 (g). Tính số nguyên tử Mg có trong 1 (mol) Mg.
Câu 105:
b) Phân tử Y có phân tử khối bằng phân tử khối của X. Y được tạo nên từ hai nguyên tố S,O.
Câu 106:
c) Phân tử Z có phân tử khối bằng 1,225 phân tử khối của X. Z được tạo nên từ những nguyên tố H, S, O trong đó số nguyên tử của H gấp đôi số nguyên tử của S và số nguyên tử O gấp đôi số nguyên tử H.
Câu 107:
Cho a gam bột Al vào dung dịch chứa 0,1 mol AgNO3; 0,15 mol Cu(NO3)2 và 0,2 mol Fe(NO3)3 thu được dung dịch X và kết tủa Y. Hãy lựa chọn giá trị của a để kết tủa Y thu được chứa 3 kim loại.
A.
B.
C.
D.