Bài tập axit tác dụng với bazơ và cách giải
Bài tập axit tác dụng với bazơ và cách giải
Haylamdo biên soạn và sưu tầm Bài tập axit tác dụng với bazơ và cách giải môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

I. Lý thuyết và phương pháp giải
- Phản ứng axit tác dụng với bazơ là phản ứng trung hòa
- Phương trình phản ứng hóa học xảy ra:
Axit + bazơ → muối + nước
- Ví dụ:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
- Phương pháp giải:
+ Bước 1: Tính số mol các chất đề bài đã cho số liệu và viết phương trình phản ứng hóa học xảy ra.
+ Bước 2: Tính toán luôn theo phương trình phản ứng hóa học hoặc đặt ẩn nếu đề bài là hỗn hợp.
+ Bước 3: Lập phương trình toán học và giải phương trình Số mol các chất cần tìm.
+ Bước 4: Tính toán theo yêu cầu đề bài.
Lưu ý: Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
II. Ví dụ minh họa
Ví dụ 1: Cần dùng bao nhiêu ml dung dịch KOH 1,5M để trung hòa hết 300ml dung dịch HCl 0,5M.
Hướng dẫn giải:
- Ta có: nHCl = 0,3.0,5 = 0,15 mol
- Phương trình phản ứng hóa học:
KOH + HCl → KCl +H2O
0,15←0,15 mol
V(KOH) =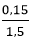 = 0,1 lít = 100 ml
= 0,1 lít = 100 ml
Ví dụ 2: Cần bao nhiêu ml dung dịch NaOH 0,75M để trung hòa 400ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M.
Hướng dẫn giải:
Ta có: nH2SO4 = 0,4.0,5 = 0,2 mol
nHCl = 0,4.1 = 0,4 mol
Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,4 ← 0,2
NaOH + HCl → NaCl + H2O
0,4 ← 0,4
⇒nNaOH = 0,4 + 0,4 = 0,8 mol
⇒V(NaOH) = 0,8/0,75 = 1,07 lít = 1070ml
III. Bài tập vận dụng
Bài 1: Khi cho 500ml dung dịch NaOH 1M tác dụng hết với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
A. 250 ml
B. 400 ml
C. 500 ml
D. 125 ml
Hướng dẫn giải:
Đáp án D
Ta có: nNaOH = 0,5.1 = 0,5 mol
Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,5 → 0,25 mol
⇒VH2SO4=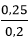 = 0,125 lít
= 0,125 lít
Bài 2: Cho 100ml dd Ba(OH)2 1M vào 100ml dd H2SO4 0,8M. Khối lượng kết tủa thu được là:
A. 23,30 g
B. 18,64 g
C. 1,86 g
D. 2,33 g
Hướng dẫn giải:
Đáp án B
Ta có: nBa(OH)2 = 0,1 mol
nH2SO4 = 0,08 mol
Phương trình phản ứng hóa học :
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O
0,1 0,08 mol
Ta có: 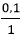 >
>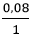 ⇒Ba(OH)2 dư, H2SO4 hết.
⇒Ba(OH)2 dư, H2SO4 hết.
⇒n↓ = nBaSO4 = nH2SO4 = 0,08 mol
⇒ m↓ = 0,08.233 = 18,64 g
Bài 3: Cần dùng bao nhiêu ml dung dịch KOH 1,5M để trung hòa hết dung dịch A chứa 300ml dung dịch HCl 1,5M và dung dịch H2SO4 0,75M.
A. 300ml
B. 450ml
C. 600ml
D. 500ml
Hướng dẫn giải:
Đáp án C
Ta có: nHCl = 1,5.0,3 = 0,45 mol
nH2SO4 = 0,75.0,3 = 0,225 mol
Phương trình phản ứng hóa học:
2KOH + H2SO4 → K2SO4 + 2H2O
0,45 ← 0,225 mol
KOH + HCl → KCl + H2O
0,45 ← 0,45 mol
⇒ nKOH = 0,45 + 0,45 = 0,9 mol
⇒ VKOH =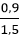 = 0,6 lít = 600ml
= 0,6 lít = 600ml
Bài 4: Hòa tan hết 4,6 gam Na vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là:
A. 100 ml
B. 200 ml
C. 300 ml
D. 400 ml
Hướng dẫn giải:
Đáp án B
Ta có: nNa =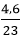 = 0,2 mol
= 0,2 mol
Phương trình phản ứng hóa học:
2Na + 2H2O → 2NaOH + H2
0,2 → 0,2 mol
NaOH + HCl → NaCl + H2O
0,2 → 0,2 mol
⇒nHCl = 0,2 mol ⇒ VHCl =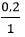 = 0,2 lít = 200 ml
= 0,2 lít = 200 ml
Câu 5: Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. Khối lượng dung dịch NaOH cần dùng là:
A. 100 g
B. 80 g
C. 90 g
D. 150 g
Hướng dẫn giải:
Đáp án B
Ta có: nH2SO4 = 0,2 mol
Phương trình phản ứng hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,4 ← 0,2 mol
⇒mNaOH = 0,4.40 = 16g
⇒mdd(NaOH) =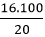 = 80g
= 80g
Câu 6: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%:
A. 400 g
B. 500 g
C. 420 g
D. 570 g
Hướng dẫn giải:
Đáp án B
Ta có: mKOH =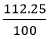 = 23g
= 23g
⇒nKOH = 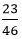 = 0,5 mol
= 0,5 mol
Phương trình phản ứng hóa học:
2KOH + H2SO4 → K2SO4 + 2H2O
0,5 → 0,25 mol
⇒ mH2SO4= 0,25.98 = 24,5g
⇒ mdd(H2SO4)=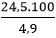 = 500g
= 500g
Bài 7: Khối lượng dung dịch NaOH 10% cần để trung hoà 200 ml dung dịch HCl 1M là:
A. 80g.
B. 100g.
C. 160g.
D. 200g.
Hướng dẫn giải:
Đáp án A
Ta có: nHCl = 0,2 mol
Phương trình phản ứng hóa học:
NaOH + HCl → NaCl + H2O
0,2 ← 0,2 mol
⇒ mNaOH = 0,2.40 = 8g
⇒ mdd(NaOH) = 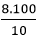 = 80g
= 80g
Câu 8: Trung hoà 200g dung dịch HCl 3,65% bằng dung dịch KOH 1M. Thể tích dung dịch KOH cần dùng là:
A. 100 ml.
B. 300 ml.
C. 400 ml.
D. 200 ml.
Hướng dẫn giải:
Đáp án D
Ta có: mHCl =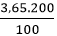 = 7,3g⇒ nHCl =
= 7,3g⇒ nHCl = 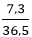 = 0,2 mol
= 0,2 mol
Phương trình phản ứng hóa học :
KOH + HCl → KCl + H2O
0,2 ← 0,2 mol
VKOH = 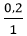 = 0,2 lít = 200ml
= 0,2 lít = 200ml
Bài 9: Cho 1,25 lít dung dịch KOH 1M tác dụng vừa đủ với x lít dung dịch HCl 0,5M. Giá trị của x là
A. 1,25
B. 2,0
C. 2,5
D. 2,75
Hướng dẫn giải:
Đáp án C
Ta có: nKOH = 1,25 mol
Phương trình phản ứng hóa học:
KOH + HCl → KCl + H2O
1,25 → 1,25
⇒ x =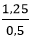 = 2,5
= 2,5
Bài 10: Cho 44,78 gam hỗn hợp A gồm KOH và Ba(OH)2 vào 400 gam dung dịch HCl vừa đủ, phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 56,065 gam hỗn hợp muối. Nồng độ phần trăm của BaCl2 trong dung dịch X là
A. 8,42%.
B. 5,34%.
C. 9,36%.
D. 14,01%.
Hướng dẫn giải:
Đáp án A
Đặt: nKOH = x mol; nBa(OH)2= y mol
Phương trình phản ứng hóa học:
KOH + HCl → KCl + H2O
x → x → x mol
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
y → 2y → y mol
Ta có: mA = 56x + 171y = 44,78 (1)
Mmuối = 74,5x + 208y = 56,065 (2)
Từ (1) và (2) x = 0,25; y = 0,18
Ta có : mdd X = mA + mdd HCl = 44,78 + 400 = 444,78 g
mBaCl2= 0,18.208 = 37,44 g
⇒ C%BaCl2=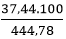 ≅8,42%
≅8,42%

