Bài tập tổng hợp phản ứng trao đổi hóa vô cơ và cách giải
Bài tập tổng hợp phản ứng trao đổi hóa vô cơ và cách giải
Haylamdo biên soạn và sưu tầm Bài tập tổng hợp phản ứng trao đổi hóa vô cơ và cách giải môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

I. Lý thuyết và phương pháp giải
- Phản ứng trao đổi là phản ứng hóa học, trong đó các chất trao đổi nguyên tử hoặc nhóm nguyên tử với nhau.
- Một số phản ứng trao đổi thường gặp:
+/ Muối + muối → 2 muối mới
Ví dụ: K2SO4 + Ba(NO3)2 → BaSO4↓ + 2KNO3
+/ Bazơ + muối → muối mới + bazơ mới
Ví dụ: 2NaOH + CuSO4 → Cu(OH)2↓+ Na2SO4
+/ Axit + muối → muối mới + axit mới
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Lưu ý: Điều kiện xảy ra phản ứng: Sản phẩm tạo thành: có chất kết tủa (↓) hoặc bay hơi (↑) hoặc H2O
Phương pháp giải
- Bước 1: Xử lí số liệu đề bài cho và viết phương trình phản ứng hóa học.
- Bước 2: Đặt ẩn, lập hệ phương trình (nếu cần).
- Bước 3: Giải hệ phương trình (nếu có) và tính toán theo yêu cầu đề bài.
II. Ví dụ minh họa
Ví dụ 1: Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Giá trị của a là
Hướng dẫn giải:
Phương trình phản ứng hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
n↑= nCO2=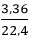 = 0,15mol
= 0,15mol
⇒ nNa2CO3= nCO2= 0,15 mol
⇒ a = mNa2CO3= 0,15.106 = 15,9g
Ví dụ 2: Cho 2,74 gam Ba hòa tan hoàn toàn vào H2O tạo thành dd X. Cho dung dịch X phản ứng với dung dịch H2SO4 dư. Tính khối lượng kết tủa tạo thành.
Hướng dẫn giải:
Ta có: nBa =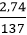 = 0,02 mol
= 0,02 mol
Phương trình phản ứng hóa học:
Ba + 2H2O → Ba(OH)2 + H2
0,02 0,02 mol
Dung dịch X là dung dịch Ba(OH)2 (0,02 mol)
⇒ Phương trình phản ứng hóa học:
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
0,02 0,02
⇒ m↓= mBaSO4 = 0,02.233 = 4,66g

III. Bài tập tự luyện
Bài 1: Khi cho 300 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là
A. 8,8 g
B. 13,2 g
C. 10,08 g
D. 6,72 g
Bài 2: Cho dd chứa m gam BaCl2 tác dụng với dd H2SO4 dư tạo thành 4,66 gam kết tủa. Giá trị của m là
A. 4,16g
B. 4,66g
C. 5,24g
D. 2,33g
Bài 3: Cho dd chứa 8,5 gam AgNO3 tác dụng hoàn toàn với NaCl dư. Tính khối lượng kết tủa tạo thành.
A. 6,175g
B. 4,125g
C. 3,5875g
D. 7,175g
Bài 4: Hoà tan hoàn toàn Na2CO3 vào V(ml) hỗn hợp dung dịch axit HCl 0,5M và H2SO4 1,5M vừa đủ thì thu được một dung dịch A và 7,84 lít khí B (đktc). Tính giá trị của V.
A. 500ml
B. 300ml
C. 200ml
D. 400ml
Bài 5: Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 g
B. 16,475 g
C. 18,645 g
D. 17,475 g
Bài 6: Trung hoà 100 ml dung dịch H2SO4 1M bằng V (ml) dung dịch NaOH 1M. Giá trị của V là
A. 50 ml .
B. 200 ml.
C. 300 ml.
D. 400 ml.
Bài 7: Hoà tan hoàn toàn Na2CO3 vào V(ml) hỗn hợp dung dịch axit HCl 0,5M và H2SO4 1,5M vừa đủ thì thu được một dung dịch A và 3,92 lít khí B (đktc). Cô cạn dung dịch A thu được m g muối khan. Tính giá trị của m.
A. 24,525
B. 26,3
C. 26,575
D. 22,75
Bài 8: Cho 40g dung dịch Ba(OH)2 34,2% vào dung dịch Na2SO4 14,2% . Khối lượng dung dịch Na2SO4 vừa đủ phản ứng là:
A. 100g
B. 80g
D. 40g
C. 60g
Bài 9: Cho 100 ml dung dịch H2SO4 2M tác dụng với 100 ml dung dịch Ba(NO3)2 1M. Nồng độ mol của dung dịch sau phản ứng lần lượt là:
A. H2SO4 1M và HNO3 0,5M.
B. BaSO4 0,5M và HNO3 1M.
C. HNO3 0,5M và Ba(NO3)2 0,5M.
D. H2SO4 0,5M và HNO3 1M.
Bài 10: Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 14g
B. 8g
C. 16g
D. 12g
Đáp án minh họa
1B |
2A |
3D |
4C |
5D |
6B |
7A |
8B |
9D |
10B |

