Bài tập muối tác dụng với muối và cách giải
Bài tập muối tác dụng với muối và cách giải
Haylamdo biên soạn và sưu tầm Bài tập muối tác dụng với muối và cách giải môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

I. Lý thuyết
- Phản ứng xảy ra giữa hai dung dịch muối thường là phản ứng trao đổi.
- Phương trình phản ứng hóa học tổng quát:
Muối + muối → 2 muối mới
Ví dụ: KCl + AgNO3 → KNO3 + AgCl↓
- Lưu ý: Điều kiện xảy ra phản ứng:
+ Chất phản ứng: hai muối tham gia phản ứng phải tan.
+ Sản phẩm: có chất kết tủa (↓) hoặc bay hơi (↑) hoặc H2O
- Một số trường hợp đặc biệt:
ZnSO4 + Na2CO3 + H2O → Zn(OH)2 + Na2SO4 + CO2
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag ↓
- Phương pháp giải:
+ Bước 1: Xử lí số liệu đề bài cho và viết phương trình phản ứng hóa học.
+ Bước 2: Đặt ẩn, lập hệ phương trình (nếu cần).
+ Bước 3: Giải hệ phương trình (nếu có) và tính toán theo yêu cầu đề bài.
II. Ví dụ minh họa
Ví dụ 1: Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
Hướng dẫn giải:
Ta có: nNaCl = 2.0,5 = 1 mol
nAgNO3 = 2.0,6 = 1,2 mol
Phương trình phản ứng hóa học:
NaCl + AgNO3 → NaNO3 + AgCl↓
mol 1 1,2
Ta có : 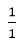 <
<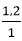 NaCl hết, AgNO3 dư
NaCl hết, AgNO3 dư
⇒ n↓ = nAgCl = nNaCl = 1 mol
⇒ m↓ = 1.143,5 = 143,5 g
Ví dụ 2: Cho 0,1 mol FeCl3 tác dụng hết với dung dịch Na2CO3 dư, thu được chất khí B và kết tủa C. Đem nung C đến khối lượng không đổi thu được chất rắn D. Tính thể tích khí B (đktc) và khối lượng chất rắn D.
Hướng dẫn giải:
2FeCl3 + 3H2O + 3Na2CO3 → 2Fe(OH)3 + 3CO2 + 6NaCl
0,1 0,1 0,15 mol
⇒ Chất khí B là CO2, kết tủa C là Fe(OH)3
⇒ VCO2= 0,15.22,4 = 3,36 lít
2Fe(OH)3 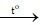 Fe2O3 + 3H2O
Fe2O3 + 3H2O
0,1 0,05
⇒ Chất rắn D là Fe2O3
⇒ mD = 0,05.160 = 8 g
III. Bài tập tự luyện
Bài 1 : Cho dung dịch NaCl 2M tác dụng vừa đủ với dung dịch AgNO3 1M. Thu được 28,7g kết tủa. Thể tích dung dịch NaCl và dung dịch AgNO3 cần dùng lần lượt là
A. 100ml và 200ml
B. 200ml và 200ml
C. 200ml và 100ml
D. 150ml và 300ml
Bài 2: Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 3,4 g AgNO3. Tính khối lượng chất rắn sinh ra.
A. 2,583 g
B. 2,1525 g
C. 2,87 g
D. 1,435 g
Bài 3 : Cho 3,22 g ZnSO4 tác dụng với dung dịch Na2CO3 0,2M. Tính thể tích dung dịch Na2CO3 đã tham gia phản ứng.
A. 0,2 lít
B. 0,5 lít
C. 0,1 lít
D. 0,4 lít
Bài 4: Trộn 100g dung dịch AgNO3 17% với 200g dung dịch Fe(NO3)2 18% thu được kết tủa A. Tính khối lượng kết tủa A.
A. 27g
B. 16,2g
C. 10,8g
D. 21,6g
Bài 5: Cho 500ml dung dịch BaCl2 phản ứng với dung dịch Na2SO4 dư, thu được 11,65g kết tủa. Tính nồng độ mol của dung dịch BaCl2.
A. 0,1M
B. 0,2M
C. 0,3M
D. 0,4M
Bài 6: Cho 400ml dung dịch K2CO3 0,1M vào 200ml dung dịch BaCl2 0,1M đến khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 3,94 gam.
B. 3,49 gam.
C. 7,88 gam.
D. 11,70 gam.
Bài 7: Cho 16,1 g ZnSO4 tác dụng vừa đủ với dung dịch K2CO3 thu được m gam kết tủa. Tính giá trị của m.
A. 8,2
B. 10,2
C. 10,8
D. 9,9
Đáp án D
Bài 8: Trộn 2 dung dịch muối nào sau đây sẽ không xuất hiện kết tủa ?
A. BaCl2, Na2SO4.
B. Na2CO3, CaCl2.
C. BaCl2, AgNO3.
D. NaCl, K2SO4.
Bài 9: Cho 11,7g NaX (X là 1 halogen) vào dung dịch AgNO3 dư, thu được 28,7g kết tủa. Tìm công thức của NaX.
A. NaBr
B. NaF
C. NaI
D. NaCl
Bài 10: Có 1 lit dung dịch hỗn hợp gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng vừa đủ với 53,4g hỗn hợp BaCl2 và CaCl2. Sau khi các phản ứng kết thúc thu được a g kết tủa. Giá trị của a là
A. 28,7
B. 49,55
C. 28,55
D. 31,2
Đáp án tham khảo
1A |
2C |
3C |
4C |
5A |
6A |
7D |
8D |
9D |
10B |

