Bài tập kim loại tác dụng với nước và cách giải
Bài tập kim loại tác dụng với nước và cách giải
Haylamdo biên soạn và sưu tầm Bài tập kim loại tác dụng với nước và cách giải môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

I. Lý thuyết và phương pháp giải
- Kim loại tác dụng với nước ở nhiệt độ thường: các kim loại kiềm, kiềm thổ (trừ Be, Mg).
⇒ Các kim loại có thể tác dụng với nước ở điều kiện thường hay gặp: Li, Na, K, Ca, Ba...
- Phương trình phản ứng hóa học tổng quát:
Kim loại + H2O → dung dịch kiềm + H2↑
- Ví dụ:
2Na + 2H2O → 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
Tổng quát: 2M + 2nH2O → 2M(OH)n + nH2 ↑
Với M là kim loại có hóa trị n.
II. Ví dụ minh họa
Ví dụ 1: Cho mẩu Na vào nước thấy thu được 4,48 lít khí ở đktc. Tính khối lượng Na?
Hướng dẫn giải:
nH2 =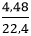 = 0,2 mol
= 0,2 mol
2Na + 2H2O → 2NaOH + H2
0,4 ← 0,2 mol
mNa = 0,4.23 = 9,2 gam
Ví dụ 2: Cho 1,24g hỗn hợp Na và K tác dụng hết với nước, sau phản ứng thu được dung dịch chứa 1,92g hỗn hợp 2 bazơ NaOH và KOH. Thể tích khí H2 sinh ra ở đktc là
Hướng dẫn giải:
Cách 1:
Đặt: nNa = x mol
nK = y mol
Phương trình phản ứng hóa học:
2Na + 2H2O → 2NaOH + H2
x x 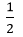 x
x
2K + 2H2O → 2KOH + H2
y y 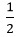 y
y
mhỗn hợp = mNa + mK = 23.x + 39.y = 1,24 (1)
mhh bazơ = mNaOH + mKOH = 40.x + 56.y = 1,92 (2)
Từ (1) và (2) ta có hệ phương trình :
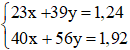 ⇒
⇒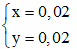
⇒ nH2 =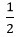 x +
x + 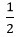 y = 0,02 ⇒ VH2 = 0,02.22,4 = 0,448 lít
y = 0,02 ⇒ VH2 = 0,02.22,4 = 0,448 lít

III. Bài tập tự luyện
Bài 1: Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%.
B. 4,0%.
C.23,0%.
D. 5,8%.
Bài 2: Cho 1 g hợp kim của natri tác dụng với nước ta thu được dung dịch kiềm, để trung hoà lượng kiềm đó cần phải dùng 50ml dung dịch HCl 0,2M. Thành phần % của natri trong hợp kim là:
A. 39,5%
B. 23%
C. 46%
D. 24%
Bài 3: Cho 3,66 gam hỗn hợp 2 kim loại Na và Ba tác dụng với một lượng nước dư, thấy thoát ra 0,896 lít khí H2 đktc. Tổng khối lượng bazơ sinh ra là:
A. 4,2 g
B. 4,3g
C. 5,02g
D. 5,2g
Bài 4: Hòa tan hết 4,6 gam Na vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là:
A. 100 ml
B. 200 ml
C. 300 ml
D. 400 ml
Bài 5: Cho 8,5g hỗn hợp Na và K tác dụng với nước thu được 3,36l khí hiđro (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m(g) kết tủa. Giá trị của m là:
A. 5,35g
B. 16,05g
C. 21,40g
D. 10,70g
Bài 6: Cho 0,6 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IA tác dụng hết với H2O (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là: (cho Li = 7, Na= 23, K = 39; Ca = 40)
A. Li và Na.
B. Li và K
C. Na và K.
D. Ca và K
Bài 7: Cho 0,85 g hỗn hợp 2 kim loại Na và K tác dụng hết với nước, sau phản ứng thu được 0,336 lít khí H2 (đktc). Tổng khối lượng hiđroxit có trong dung dịch sau phản ứng là:
A. 1,36g
B. 1,06g
C. 3,02g
D. 2,54g
Bài 8: Cho hỗn hợp X gồm 2 kim loại kiềm tan hết trong nước tạo ra dung dịch Y và thoát ra 0,12 mol H2. Thể tích dung dịch H2SO4 2M cần trung hòa dung dịch Y là:
A.120ml
B. 60ml
C.150ml
D.200ml
Bài 9: Cho một hỗn hợp kim loại Na-Ba tác dụng với nước dư, thu được dung dịch X và 3,36l H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X là:
A.150ml
B.75ml
C.60ml
D.30ml
Bài 10: Cho hỗn hợp Na, K, Ba tác dụng hết với nước, thu được dung dịch X và 6,72l khí H2 (đktc). Nếu cho X tác dụng hết với dung dịch Al(NO3)3 thì khối lượng kết tủa lớn nhất thu được là:
A.7,8g
B.15,6g
C.46,8g
D.3,9g
Đáp án tham khảo:
1B |
2B |
3C |
4B |
5D |
6A |
7A |
8B |
9A |
10B |

