Cách giải bài tập Oxit axit tác dụng với bazo hay, chi tiết
Cách giải bài tập Oxit axit tác dụng với bazo hay, chi tiết
Haylamdo biên soạn và sưu tầm Cách giải bài tập Oxit axit tác dụng với bazo hay, chi tiết môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

Lý thuyết và Phương pháp giải
TH1: Khi oxit axit (CO2, SO2…) tác dụng với dung dịch kiềm (KOH, NaOH…)
PTHH:
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Phương pháp giải
Bước 1: Xét tỉ lệ: .

- Nếu T ≤ 1 thì sản phẩm thu được là muối axit ⇒ Chỉ xảy ra phản ứng (1)
- Nếu 1 < T < 2 thì sản phẩm thu được là muối axit và muối trung hòa ⇒ Xảy ra cả 2 phản ứng (1) và (2)
- Nếu T ≥ 2 thì sản phẩm thu được là muối trung hòa ⇒ Chỉ xảy ra phản ứng (2).
Bước 2: Viết PTHH và tính toán theo PTHH (nếu xảy ra cả 2 phản ứng thì cần đặt ẩn và giải theo hệ phương trình)
Bước 3: Tính toán theo yêu cầu của đề bài
TH2: Khi oxit axit (CO2, SO2…) tác dụng với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
PTHH:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Phương pháp giải
Bước 1: Xét tỉ lệ: .
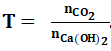
-Nếu T ≤ 1 thì sản phẩm thu được là muối trung hòa ⇒ Chỉ xảy ra phản ứng (1)
-Nếu 1 < T < 2 thì sản phẩm thu được là muối axit và muối trung hòa ⇒ Xảy ra cả 2 phản ứng (1) và (2)
-Nếu T ≥ 2 thì sản phẩm thu được là muối axit ⇒ Chỉ xảy ra phản ứng (2).
Bước 2: Viết PTHH và tính toán theo PTHH (nếu xảy ra cả 2 phản ứng thì cần đặt ẩn và giải theo hệ phương trình).
Bước 3: Tính toán theo yêu cầu của đề bài.trên.
Lưu ý: Nếu không đủ dữ kiện để xét T, ta chia trường hợp có thể xảy ra và giải theo từng trường hợp như các bước ở trên.
Bài tập vận dụng
Bài 1: Nung 20 g CaCO3 và hấp thụ hoàn toàn khí CO2 sinh ra vào 0,5 lit dung dịch NaOH 0,56 M .Tính nồng độ mol của muối thu được. (thể tích thay đổi không đáng kể)
Hướng dẫn:
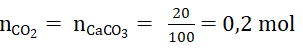
nNaOH = 0,56 . 0.5 = 0,28 mol

Do 1 < 1,4 < 2 ⇒ sản phảm gồm muối axit và muối trung hoà
PTHH:
CO2 + NaOH → NaHCO3 (1)
x x x
CO2 + 2NaOH → Na2CO3 + H2O (2)
y 2y
Đặt số mol CO2 phản ứng ở PT (1), (2) lần lượt là x và y mol.
Ta có hệ phương trình:
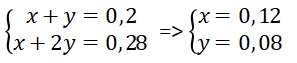
Vậy số mol của NaHCO3 là 0,12 mol.
⇒CM(NaHCO3)= 0,12:0,5 = 0,24 M
Bài 2: Sục từ từ V lít khí SO2 ở đktc vào 100 ml dung dịch Ba(OH)2 1,5M, thu được 23,3 gam kết tủa. Tính giá trị của V.
Hướng dẫn:
Ta có: nBa(OH)2 = 0,15 mol; nBaSO3 = 0,1 mol.
Vì n↓ < nBa(OH)2 nên kết tủa chưa cực đại ⇒ Có các trường hợp sau:
- Trường hợp 1: Ba(OH)2 dư ⇒ muối tạo thành chỉ có BaSO3
PTHH: SO2 + Ba(OH)2 → BaSO3 + H2O
0,1 0,1 (mol)
⇒ VSO2 = 0,1 x 22,4 = 2,24 lít
- Trường hợp 2: SO2 hết nhưng đã hòa tan 1 phần kết tủa.
PTHH: SO2 + Ba(OH)2 → BaSO3 + H2O (1)
0,15 0,15 0,15 (mol)
Theo (1) thì nBaSO3 = 0,15mol, nhưng theo đề thì nBaSO3 = 0,1mol ⇒ nBaSO3 bị hòa tan: 0,15 – 0,05 = 0,1 mol
SO2 + H2O + BaSO3 → Ba(HSO3)2 (2)
0,05 0,05 (mol)
⇒ VSO2 = (0,15 + 0,05) x 22,4 = 4,48 lít

