Bài tập kim loại tác dụng với axit và cách giải
Bài tập kim loại tác dụng với axit và cách giải
Haylamdo biên soạn và sưu tầm Bài tập kim loại tác dụng với axit và cách giải môn Hoá học lớp 9 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Hóa 9.

I. Lý thuyết và phương pháp giải
- Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
Các kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại có thể tác dụng được với dung dịch axit (như H2SO4 loãng, HCl …) tạo thành muối và giải phóng H2.
Ví dụ:
Mg + H2SO4 loãng → MgSO4 + H2 ↑
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Chú ý:
- Các kim loại có nhiều hóa trị khi tác dụng với các axit HCl; H2SO4 loãng… thu được muối trong đó kim loại ở mức hóa trị thấp nhất.
Ví dụ: Fe + 2HCl → FeCl2 + H2 ↑
- Nếu kim loại tan trong nước (như Na, K…) tác dụng với dung dịch axit (HCl; H2SO4 loãng …) giải phóng H2, thì cần lưu ý:
+) Nếu dung dịch axit dư chỉ có phản ứng kim loại + axit.
+) Nếu kim loại dùng dư, xét các phản ứng theo thứ tự:
1) Kim loại + axit
2) Kim loại + nước trong dung dịch.
- Kim loại tác dụng với axit sunfuric đặc tạo thành muối sunfat và không giải phóng H2.
Ví dụ:
Cu + 2H2SO4 đặc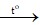 CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
2Fe + 6H2SO4đặc 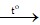 Fe2(SO4)3 + 3SO2↑ + 6H2O
Fe2(SO4)3 + 3SO2↑ + 6H2O
- Phương pháp giải
Để giải các bài tập về kim loại tác dụng với axit thông thường là áp dụng tính toán theo phương trình hóa học:
+ Bước 1: Xử lí số liệu đề bài cho và viết phương trình phản ứng hóa học.
+ Bước 2: Đặt ẩn, lập hệ phương trình (nếu cần).
+ Bước 3: Giải hệ phương trình (nếu có) và tính toán theo yêu cầu đề bài.
Ngoài ra, có thể phối hợp các phương pháp bảo toàn khối lượng, tăng giảm khối lượng, bảo toàn nguyên tố …
II. Ví dụ minh họa
Ví dụ 1: Hòa tan a gam bột sắt cần vừa đủ 600ml dung dịch H2SO4 thu được 10,08 lit khí H2(đktc) và dung dịch A.
1, Tính a?
2, Tính nồng độ mol của dung dịch axit đã dùng?
Hướng dẫn giải:
Ta có: nH2=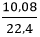 = 0,45mol
= 0,45mol
Phương trình phản ứng hóa học:
Fe + H2SO4 → FeSO4 + H2
0,45 0,45 ← 0,45 mol
a/ mFe = a = 0,45.56 = 25,2g
b/ CMdd(H2SO4) =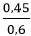 = 0,75M
= 0,75M
Ví dụ 2: Hòa tan 7g hỗn hợp 3 kim loại Al, Fe, Cu trong dung dịch H2SO4 loãng dư. Sau khi kết thúc phản ứng, thấy trong bình phản ứng còn 1,5g chất rắn và thu được 4,48 lit H2 (đktc). Tính % về khối lượng mỗi kim loại ?
Hướng dẫn giải:
Ta có: nH2 = 0,2 mol
1,5g chất rắn còn lại trong bình là khối lượng Cu vì Cu không phản ứng với dung dịch H2SO4 loãng.
⇒%mCu =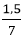 .100 = 21,43%
.100 = 21,43%
⇒mFe và Al = mhh – mCu = 7 -1,5 = 5,5g
Đặt: nAl = x mol
nFe = y mol
⇒ Ta có phương trình khối lượng: 27x + 56y = 5,5 (1)
Phương trình phản ứng hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x 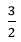 x mol
x mol
Fe + H2SO4 → FeSO4 + H2
y y mol
Ta có: nH2= 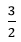 x + y = 0,2 (2)
x + y = 0,2 (2)
Từ (1) và (2) ta có hệ phương trình:
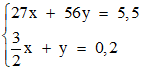 ⇒
⇒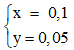
⇒%mAl = 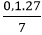 .100%= 38,57%
.100%= 38,57%
⇒%mFe = 100% – 38,57% – 21,43% = 40%
Ví dụ 3: Cho 6,8 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch H2SO4 loãng a (M) thì thu được 3,36 lít khí bay ra (đktc) và dung dịch A.
a. Tính % khối lượng mỗi kim loại trong X và khối lượng muối có trong dung dịch tạo thành sau phản ứng và a ?
b. Nếu cho hỗn hợp X tác dụng vừa đủ với H2SO4 đặc nóng thì thu được dung dịch A và V lít khí SO2 (đktc) duy nhất. Tính giá trị của V và khối lượng H2SO4 tham gia phản ứng?
Hướng dẫn giải:
Đặt: nMg = x mol
nFe = y mol
Phương trình phản ứng hóa học:
Mg + H2SO4(loãng) → MgSO4 + H2
x x x x
Fe + H2SO4(loãng) → FeSO4 + H2
y y y y
Ta có: mhhX = 24x + 56y = 6,8g (1)
nH2= x + y = 0,15 (2)
Từ (1) và (2)⇒ x = 0,05; y = 0,1
a. %mMg = 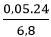 .100%= 17,65%
.100%= 17,65%
%mFe = 100% – 17,65% = 82,35%
mmuối =mMgSO4 + mFeSO4= 0,05.120 + 0,1.152 = 21,2g
nH2SO4= x + y = 0,15 mol⇒ CM(H2SO4) = 0,15 : 0,15 = 1M
b. Phương trình phản ứng hóa học:
Mg + 2H2SO4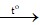 MgSO4 + SO2 + 2H2O
MgSO4 + SO2 + 2H2O
0,05→ 0,1 → 0,05 mol
2Fe + 6H2SO4  Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
0,1 → 0,3 → 0,15 mol
⇒ nSO2= 0,05 + 0,15 = 0,2 mol ⇒ V = 0,2.22,4 = 4,48 lít
⇒ mH2SO4= (0,1 + 0,3).98 = 39,2g

III. Bài tập tự luyện
Bài 1: Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối có trong dung dịch thu được sau phản ứng là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Bài 2: Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric loãng. Thể tích khí hiđro thu được ở đktc là:
A. 44,8 lít
B. 4,48 lít
C. 2,24 lít
D. 22,4 lít
Bài 3: Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Bài 4: Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 63% và 37%
C. 61% và 39%
D. 65% và 35%
Bài 5: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là:
A. Zn.
B. Mg.
C. Fe.
D. Ca.
Bài 6: Cho 8 g hỗn hợp Fe và Mg tác dụng hoàn toàn với dung dịch HCl dư sinh ra 4,48 lít khí H2 (đktc). Thành phần phần trăm về khối lượng của Fe và Mg lần lượt là:
A. 70% và 30%
B. 60% và 40%.
C.50% và 50%.
D. 80% và 20%.
Bài 7: Hoà tan hoàn toàn m gam bột Cu trong dung dịch HNO3 được dung dịch Y và 4,48 lít khí NO duy nhất (đktc). Tính m?
A. 12,8g
B. 19,2g
C. 9,6g
D. 25,6g
Bài 8: Cho 10,38 gam hỗn hợp gồm Fe, Al và Ag chia làm 2 phần bằng nhau:
- Phần 1: Tác dụng với dung dịch H2SO4 loãng dư thu được 2,352 lít khí (đktc).
- Phần 2: Tác dụng với dung dịch H2SO4 đặc, nóng dư thu được 2,912 lít khí SO2 (đktc).
Khối lượng từng kim loại trong hỗn hợp ban đầu lần lượt là:
A. 1,12g; 5,4g và 1,08g
B. 3,24g; 1,35g và 0,6g
C. 1,68g; 1,35g và 2,16g
D. 2,8g; 0,54g và 1,8g
Bài 9:Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73g dung dịch HCl 10%.
Cô cạn dung dịch thu được 13,15 gam muối. Giá trị của m là
A. 7,05.
B. 5,3.
C. 4,3.
D. 6,05.
Bài 10: Cho 5,4 gam kim loại R tan hoàn toàn trong H2SO4 đặc nóng, phản ứng kết thúc thu được dung dịch muối X và 6,72 lít SO2 sản phẩm khử duy nhất (đktc). Tìm kim loại R?
A. Fe
B. Zn
C. Cu
D. Al
Đáp án tham khảo:
1A |
2B |
3A |
4A |
5B |
6A |
7B |
8C |
9D |
10D |

