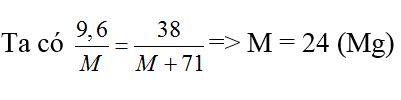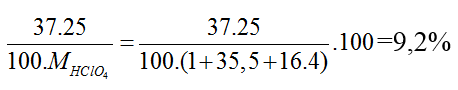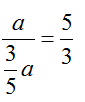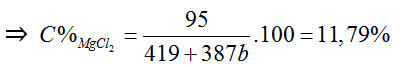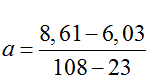100 câu trắc nghiệm Nhóm Halogen có lời giải chi tiết (nâng cao) - Hoá học lớp 10
100 câu trắc nghiệm Nhóm Halogen có lời giải chi tiết (nâng cao)
Với 100 câu trắc nghiệm Nhóm Halogen có lời giải chi tiết (nâng cao) Hoá học lớp 10 tổng hợp 100 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Halogen từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Bài 1: Cho 1,67 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA (phân nhóm chính nhóm II) tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là (cho Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137)
A. Ca và Sr. B. Sr và Ba. C. Mg và Ca. D. Be và Mg.
Lời giải:
Đáp án A.
Kim loại nhóm IIA, có mức oxi hóa = +2 trong hợp chất.
nH2 = 0,03 mol
Gọi X là kí hiệu chung của 2 kim loại
X + 2HCl → XCl2 + H2
0,03 ← 0,03 (mol)
⇒ M = 55,6
MCa = 40 < 55,67 < MSr = 88
Bài 2: Dung dịch A chứa 11,7g NaCl tác dụng với dung dịch B chứa 51g AgNO3 thu được m gam kết tủa. Giá trị của m:
A. 28,70g B. 43,05g C. 2,87g D. 4,31g
Lời giải:
Đáp án A.
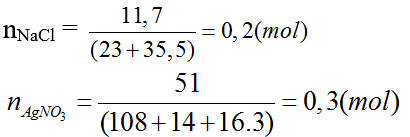
AgNO3 + NaCl → AgCl + NaNO3
0,3 0,2 → 0,2 (Mol)
(Do AgNO3 dư, nên tính theo NaCl).
mAgCl = 0,2.(108 + 35,5) = 28,7 (g)
Bài 3: Có các nhận xét sau về clo và hợp chất của clo
1. Nước Gia-ven có khả năng tẩy mầu và sát khuẩn.
2. Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển mầu hồng sau đó lại mất mầu.
3. Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4. Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl(màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
A. 2. B. 3. C. 4. D. 1
Lời giải:
Đáp án B.
Nhận xét đúng là: 1,2,4.
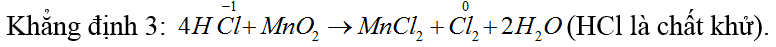
Bài 4: Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là
A. NaOH. B. Ba(OH)2. C. Ba(NO3)2. D. AgNO3.
Lời giải:
Đáp án B.
| KCl | MgCl2 | FeCl2 | FeCl3 | AlCl3 | NH4Cl | (NH4)2SO4 | |
| Ba(OH)2 | - | ↓ trắng | ↓ trắng | ↓ nâu đỏ | ↓ keo trắng | ↑ mùi khai | ↑ mùi khai + ↓ trắng |
MgCl2 +Ba(OH)2 → Mg(OH)2 + BaCl2
FeCl2 +Ba(OH)2 → Fe(OH)2 + BaCl2
2FeCl3 +3Ba(OH)2 → 2Fe(OH)3 + 3BaCl2
2AlCl3 +3Ba(OH)2 → 2Al(OH)3 + 3BaCl2
2NH4Cl + Ba(OH)2 → 2NH3 + 2H2O + BaCl2
(NH4)2SO4 + Ba(OH)2 → 2NH3 + 2H2O + BaSO4
Bài 5: Cho phản ứng: KMnO4 + HCl (đặc) to→ KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng phản ứng là các số tối giản. Số phân tử HCl đóng vai trò chất khử là:
A. 16. B. 5. C. 10. D. 8.
Lời giải:
Đáp án C
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O+ 5Cl2
Bài 6: Cho 1,03 gam muối natri halogen (NaX) tác dụng hết với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau phản ứng phân hủy hoàn toàn cho 1,08 gam Ag. X là :
A. brom. B. flo. C. clo. D. iot.
Lời giải:
Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 → AgX + NaNO3
0,01 ← 0,01 (mol)
AgX → Ag
0,01 ← 0,01 (mol)
MNaX = 1,03/0,01 = 103 ⇒ MX = 80 (Br)
Bài 7: Cho các phát biểu sau:
(1) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(2) Axit flohidric là axit yếu.
(3) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(4) Trong các hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa; -1 ; +1 ; +3 ; +5 và + 7.
(5) Tính khử của các ion halogen tăng dần theo thứ tự:
(6) Cho dung dịch AgNO3 vào các lọ đựng từng dung dịch loãng: NaF, NaCl, NaBr, NaI đều thấy có kết tủa tách ra.
Trong các phát biểu trên, số phát biểu đúng là
A. 5. B. 6. C. 3. D. 4.
Lời giải:
Đáp án D
Khẳng định đúng là 1,2,3,5
(4): Flo chỉ có số oxi hóa -1 trong hợp chất.
(6) AgF là dung dịch.
Bài 8: Cho các phản ứng sau:
a. 4HCl + MnO2 to→ MnCl2 + Cl2 + 2H2O
b. 14HCl + K2Cr2O7 to→ 2KCl + 2CrCl3 + 3Cl2 + 7H2O
c. 16HCl + 2KMnO4 to→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
d. 2HCl + Fe → FeCl2 + H2
e. 6HCl + 2Al → 2AlCl3 + 3H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 3. B. 4. C. 2. D. 1.
Lời giải:
Đáp án A.
Các phản ứng là a, b, c.
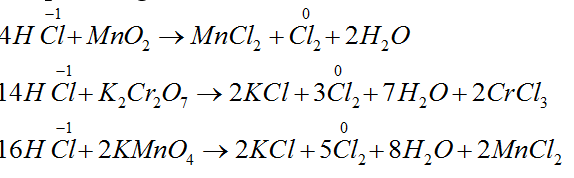
Bài 9: Cho hình vẽ mô tả thí nghiệm điều chế Clo từ MnO2 và dung dịch HCl:
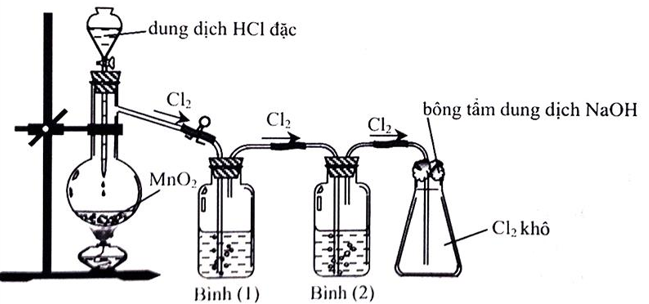
Khí Clo sinh ra thường lẫn hơi nước và khí hiđro clorua. Để thu được khí Clo khô thì bình (1) và bình (2) lần lượt đựng
A. Dung dịch H2SO4 đặc và dung dịch NaCl.
B. Dung dịch NaCl và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc và dung dịch AgNO3.
D. Dung dịch NaOH và dung dịch H2SO4 đặc.
Lời giải:
Đáp án B.

Bài 10: Nếu lấy khối lượng KMnO4 , MnO2, KClO3 bằng nhau để cho tác dụng với dd HCl đặc, dư thì chất nào cho nhiều Clo hơn?
A. MnO2 B. KClO3 C. KMnO4 D. cả 3 chất như nhau
Lời giải:
Đáp án B.
16HCl + 2KMnO4 → 5Cl2+ 2MnCl2+ 2KCl+8H2O
m/15 → m/63,2
6HCl + KClO3 → 3Cl2+ KCl+3H2O
m/122,5 → m/40,8
4HCl + MnO2 → Cl2+ MnCl2+ 2H2O
m/87 → m/87
So sánh thấy nếu lấy cùng 1 lượng các chất phản ứng với HCl thì KClO3 cho nhiều khí Cl2 nhất.
Bài 11: Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có 2 đồng vị là 35Cl và 37Cl. Phần trăm về khối lượng của 3717Cl chứa trong HClO4 (với hiđro là đồng vị 11H , oxi là đồng vị 168H ) là giá trị nào sau đây
A. 9,40%. B. 8,95%. C. 9,67%. D. 9,20%.
Lời giải:
Đáp án D.
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có
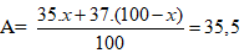
vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4 =
Bài 12: Hoà tan 174 gam hỗn hợp M2CO3 và M2SO3 (M là kim loại kiềm) vào dung dịch HCl dư. Toàn bộ khí CO2và SO2 thoát ra được hấp thụ tối thiểu bởi 500ml dung dịch NaOH 3M. Kim loại M là
A. Li. B. Na. C. K. D. Rb
Lời giải:
Đáp án B.
Gọi a, b là số mol M2CO3 và M2SO3
M2CO3 + 2HCl → 2MCl + H2O + CO2
a → a (mol)
M2SO3 + 2HCl → 2MCl + H2O + SO2
b → b (mol)
Toàn bộ khí thoát ra được hấp thụ tối thiểu bởi 500ml dung dịch NaOH 3M :
XO2 + NaOH → NaHXO3
1,5 ← 1,5 (mol)
Mhh = 174/1,5 = 116
⇒ 2M + 60 < 116 < 2M + 80 ⇒ 18 < M < 28 ⇒là Na
Bài 13: Hòa tan hoàn toàn 9,95 gam hỗn hợp X gồm Na, K và Ba vào 100 ml dung dịch HCl 1M thu được dung dịch Y và 2,24 lít khí H2 (đo ở đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m là
A. 15,2. B. 13,5. C. 17,05. D. 11,65.
Lời giải:
Đáp án A
nHCl = 0,1 (mol)
Ta có X + 2HCl → dung dịch Y + H2
0,1 0,05 (mol)
→ Kim loại còn phản ứng với nước : nOH- = 2.nH2 = 2.0,05 = 0,1 mol
Dung dịch sau phản ứng : Kim loại, Cl-: 0,1 mol, OH-: 0,1 mol
mdd = mKL + mCl + mOH- = 9,95 + 0,1.35,5 + 0,1.17 = 15,2 (gam)
Bài 14: Cho 12,1g hỗn hợp hai kim loại A, B có hoá trị (II) không đổi tác dụng với dung dịch HCl tạo ra 0,2 mol H2 . Hai kim loại đó là :
A. Ba và Cu B. Mg và Fe C. Mg và Zn D. Fe và Zn
Lời giải:
Đáp án C.
Gọi hai kim loại là M−
M− +2HCl → MCl2 + H2
0,2 ← 0,2 (mol)
MA < 60,5 < MB
⇒ A(Mg) và B là Zn
(A,B có hóa trị không đổi nên loại Fe, ý A Cu không phản ứng với HCl).
Bài 15: Cho các mệnh đề sau:
(a) Các halogen đều có số oxi hóa dương trong một số hợp chất.
(b) HI là axit mạnh nhất.
(c) Các halogen đều có tính khử mạnh.
(d) Iot có khả năng thăng hoa.
Số mệnh đề không đúng là
A. 3. B. 2. C. 4. D. 1.
Lời giải:
Đáp án B.
a) Flo chỉ có số oxi hóa – 1.
c) Các halogen có tính oxi hóa mạnh.
Bài 16: Cho phản ứng:
NaX(rắn) + H2SO4 (đậm đặc) → NaHSO4 + HX(khí)
Các hiđro halogenua (HX) có thể điều chế theo phản ứng trên là:
A. HCl, HBr và HI C. HBr và HI
B. HF và HCl D. HF, HCl, HBr và HI
Lời giải:
Đáp án B.
Bài 17: Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là 2 nguyên tố halogen ở 2 chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34g kết tủa.Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Công thức của hai muối là
A. NaBr và NaI. B. NaF và NaCl.
C. NaCl và NaBr. D. NaF, NaBr.
Lời giải:
Đáp án A.
Hỗn hợp (NaX, NaY) = NaM.
NaM + AgNO3 → AgM↓+NaNO3
Ta có
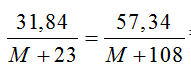
⇒ M = 81,6 ⇒ X,Y lần lượt là Br (80) và I (127)
Bài 18: Cho m gam bột sắt vào dung dịch hỗn hợp gồm 0,15 mol CuSO4 và 0,2 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,725m gam hỗn hợp kim loại. Giá trị của m là
A. 16,0. B. 18,0. C. 16,8. D. 11
Lời giải:
Đáp án A.
Fe + 2H+ → Fe2+ + H2
Fe + Cu2+ → Fe2+ + Cu
Bảo toàn khối lượng:
mFe + mCu2+ + mH+ = mhhKL + mH2 + mFe2+
m + 64.0,15 + 0,2 = 0,725m + 2.0,1 + 56.0,25
⇒ m = 16g
Bài 19: Đốt cháy hoàn toàn 5,8 gam hỗn hợp gồm Zn và Mg trong không khí thu được hỗn hợp oxit X. Hòa tan hết X trong dung dịch HCl 1M. Thể tích dung dịch axit hòa tan hết được X là :
A. 250 ml. B. 500 ml. C. 100 ml. D. 150 ml.
Lời giải:
Đáp án A.
Giả sử chỉ có Zn ⇒ nZn = 0,09 mol ⇒ nHCl = 0,18 ⇒ V = 180 ml
Nếu chỉ có Mg ⇒ nMg = 0,24 mol ⇒ nHCl = 0,48 ⇒ V = 480 ml
⇒ 180 ml < VHCl < 480 ml
Bài 20: Cho 0,03 mol hỗn hợp NaX và NaY ( X, Y là hai halogen thuộc chu kì kế tiếp – đều tạo kết tủa với AgNO3) tác dụng với lượng dư dung dịch AgNO3 thu được 4,75 gam kết tủa. Công thức hai muối trên là:
A. NaBr, NaI. B. NaF, NaCl.
C. NaCl, NaBr. D. NaF, NaCl hoặc NaBr, NaI.
Lời giải:
Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓ + NaNO3
0,03 → 0,03 (mol)
MAgM = 4,75/0,03 = 158,3 ⇒ M = 50,3 ⇒ X,Y lần lượt là Cl và Br.
Bài 21: Hoà tan hoàn toàn 25,12 gam hỗn hợp Mg, Al, Fe trong dung dịch HCl dư thu được 13,44 lít khí H2 (đktc) và m gam muối. Giá trị của m là :
A. 67,72. B. 46,42. C. 68,92 D. 47,02.
Lời giải:
Đáp án A.
nH2 = 0,6 mol;
⇒ nHCl = 2nH2 = 1,2 (mol)
mmuối = mKL + mgốc axit = 25,12 + 35,5.1,2 = 67,72 (g)
Bài 22: Mức độ phân cực của liên kết hóa học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là:
A. HI, HCl, HBr. B. HCl, HBr, HI.
C. HBr, HI, HCl. D. HI, HBr, HCl.
Lời giải:
Đáp án B.
Độ âm điện giảm dần từ Cl > Br > I, nên độ phân cực giảm dần từ HCl đến HI.
Bài 23: Hãy chỉ ra mệnh đề không chính xác:
A. Tất cả muối AgX (X là halogen) đều không tan trong nước.
B. Tất cả các hiđro halogenua đều tồn tại ở thể khí, ở điều kiện thường.
C. Tất cả các hiđro halogenua khi tan vào nước đều cho dung dịch axit.
D. Các halogen (từ F2 đến I2) tác dụng trực tiếp với hầu hết các kim loại.
Lời giải:
Đáp án A.
AgF là muối tan trong nước.
Bài 24: Cho sơ đồ:
Cl2 + KOH → A + B + H2O ;
Cl2 + KOH to→ A + C + H2O
Công thức hoá học của A, B, C, lần lượt là :
A. KCl, KClO, KClO4. B. KClO3, KCl, KClO.
C. KCl, KClO, KClO3. D. KClO3, KClO4, KCl.
Lời giải:
Đáp án C.
Cl2 + 2KOH → KCl + KClO + H2O
3Cl2 + 6KOH to→ 5KCl + KClO3 + 3H2O
Bài 25: Dẫn 2 luồng khí clo đi qua 2 dung dịch KOH : Dung dịch thứ nhất loãng và nguội, dung dịch thứ 2 đậm đặc và đun nóng ở 100oC. Nếu lượng muối KCl sinh ra trong 2 dung dịch bằng nhau thì tỉ lệ thể tích khí clo đi qua dung dịch thứ nhất và thứ 2 là :
A. 1 : 3. B. 2 : 4. C. 4 : 4. D. 5 : 3.
Lời giải:
Đáp án D.
Lượng muối KCl sinh ra trong hai dung dịch bằng nhau, giả sử là a mol.
Cl2 + 2KOH → KCl + KClO + H2O (1)
a ← a
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O (2)
3a/5 ← a
Tỉ lệ thể tích khí clo đi qua dung dịch thứ nhất và thứ 2 là =
Bài 26: Cho các chất sau : KOH (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), K2SO4 (6). Axit HCl tác dụng được với các chất :
A. (1), (2), (4), (5). B. (3), (4), (5), (6).
C. (1), (2), (3), (4). D. (1), (2), (3), (5).
Lời giải:
Đáp án A.
HCl không phản ứng được với Ag, loại (3)
Bài 27: Cho các chất sau : CuO (1), Zn (2), Ag (3), Al(OH)3 (4), KMnO4 (5), PbS (6), MgCO3 (7), AgNO3 (8), MnO2 (9), FeS (10). Axit HCl không tác dụng được với các chất
A. (1), (2). B. (3), (4). C. (5), (6). D. (3), (6).
Lời giải:
Đáp án D.
Ag đứng sau (H) trong dãy hoạt động hóa học nên không phản ứng với HCl.
PbS là kết tủa không tan trong axit.
Bài 28: Cho các phản ứng :
(1) O3 + dung dịch KI → (2) F2 + H2O to →
(3) MnO2 + HCl đặc to → (4) Cl2 + dung dịch H2S →
Các phản ứng tạo ra đơn chất là :
A. (1), (2), (3). B. (1), (3), (4). C. (2), (3), (4). D. (1), (2), (4).
Lời giải:
Đáp án A.
O3 + 2KI +H2O → O2 + 2KOH + I2.
2F2 + 2H2O → O2 +4 HF
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl.
Bài 29: Biết oxit cao nhất của nguyên tố X thuộc nhóm VIIA, có tỉ lệ khối lượng giữa các nguyên tố là mX : mO = 7,1 : 11,2. X là nguyên tố nào sau đây ?
A. Clo. B. Iot. C. Flo. D. Brom.
Lời giải:
Đáp án A.
Oxit cao nhất của X có dạng: X2O7
mX : mO = 7,1 : 11,2
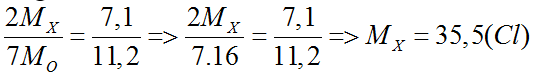
Bài 30: Hai miếng sắt có khối lượng bằng nhau và bằng 2,8 gam. Một miếng cho tác dụng với Cl2, một miếng cho tác dụng với dung dịch HCl. Tổng khối lượng muối clorua thu được là :
A. 14,475 gam. B. 16,475 gam. C. 12,475 gam. D. Tất cả đều sai.
Lời giải:
Đáp án A
nFe = 0,05 (mol)
Fe + 2HCl → FeCl2 + H2
0,05 → 0,05
⇒ mFeCl2 = 0,05.(56 + 35,5.2) = 6,35g
2Fe +3Cl2 → 2FeCl3
0,05 0,05
⇒ mFeCl2 = 0,05.(56 + 35,5.3) = 8,125g
mMuối = 6,35 + 8,125 = 14,475 (g)
Cho 69,6 gam MnO2 tác dụng với HCl đặc, dư.(H%=90%). Dẫn toàn bộ lượng khí sinh ra vào 500 ml dung dịch NaOH 4M thu được dung dịch A
Bài 31: Thể tích khí Cl2 thu được ở đktc sau phản ứng là:
A. 17,92 B.16,128 C.19,9 D.13,44
Lời giải:
Đáp án B.
Bài 32: Coi thể tích dung dịch thay đổi không đáng kể, nồng độ mol các chất trong dung dịch A sau phản ứng là bao nhiêu ?
A. 1,6M; 1,6M và 0,8M. B. 1,7M; 1,7M và 0,8 M.
C. 1,44M; 1,44M và 1,12 M. D. 1,44M ; 1,44M và 0,56M.
Lời giải:
Đáp án C
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,8 → 0,8. 90/100 = 0,72
(mol)Vkhí = 0,72.22,4 = 16,128 (lit)
nNaOH = 2 (mol)
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,72 2 → 0,72 0,72 (mol) do NaOH dư, tính theo Cl2
Dung dịch sau phản ứng: nNaCl = nNaClO = 0,72 (mol), nNaOH dư = 0,56 (mol)
CNaCl = CNaClO = 1,44M, CNaOH = 1,12M.
Bài 33: Sục khí clo vào dung dịch chứa NaBr và NaI đến phản ứng hoàn toàn thì thu được 1,17 gam NaCl. Số mol hỗn hợp NaBr và NaI có trong dung dịch đầu là :
A. 0,02 mol. B. 0,01 mol. C. 0,03 mol. D. Tất cả đều sai.
Lời giải:
Đáp án A.
Đặt: nNaBr = a(mol), nNaI = b(mol)
Ta có các phản ứng:
2NaBr + Cl2 → 2NaCl + Br2(1)
a → a
2NaI + Cl2 → 2NaCl + I2(2)
b → b
Từ (1) và (2)⇒ nNaCl = a+b = 1,17 / 58,5 = 0,02 (mol)
→ nNaBr + nNaI = a+b = 0,02 (mol)
Bài 34: Hoà tan hoàn toàn 104,25 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch A. Sục khí clo dư vào dung dịch A. Kết thúc thí nghiệm, cô cạn dung dịch, thu được 58,5 gam muối khan. Khối lượng NaCl có trong hỗn hợp X là :
A. 17,55 gam. B. 29,25 gam. C. 58,5 gam. D. Cả A, B, C đều sai.
Lời giải:
Đáp án B.
Gọi x, y là số mol NaCl và NaI trong hh X.
m(X) = m(NaCl) + m(NaI) = 58,5x + 150y = 104,25g (1)
Sục khí Cl2 dư vào dd A:
NaI + 1/2Cl2 → 1/2I2 + NaCl
y → y
mmuối= m(NaCl) = 58,5.(x+y) = 58,5g
→ x + y = 1mol (2)
Giải hệ PT (1), (2) ta được: x = 0,5mol và y = 0,5 mol
mNaCl = 0.5.58,5 = 29,25 (g)
Bài 35: Hoà tan 11,2 lít khí HCl (đktc) vào m gam dung dịch HCl 16%, thu được dung dịch HCl 20%. Giá trị của m là :
A. 36,5. B. 182,5. C. 365,0. D. 224,0.
Lời giải:
Đáp án C.
nHCl = 0,5 (mol), mHCl thêm vào = 0,5.36,5 = 18,25 (g)
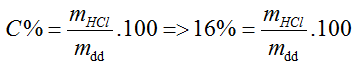
→ mHCl (trong dung dịch 16%) = 0,16mdd
Sau khi thêm 11,2 lít khí Cl2.
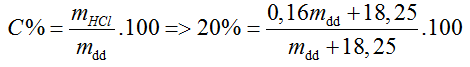
→ mdd = 365 (g)

Bài 36: Hoà tan V lít khí HCl (đktc) vào 185,4 gam dung dịch HCl 10% thu được dung dịch HCl 16,57%. Giá trị của V là
A. 4,48. B. 8,96. C. 2,24. D. 6,72.
Lời giải:
Đáp án B.
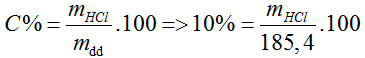
→ mHCl = 18,54 (g)
Gọi số mol HCl thêm vào = x (mol)
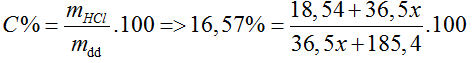
→ x= 0,4 (mol), VHCl = 0,4.22,4 = 8,96 (l)
Bài 37: Nồng mol/lít của dung dịch HBr 16,2% (d = 1,02 g/ml) là :
A. 2,04. B. 4,53. C. 0,204. D. 1,65.
Lời giải:
Đáp án A
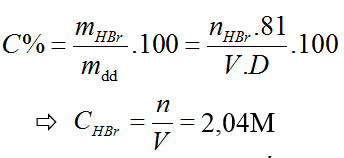
Bài 38: Hàng năm thế giới cần tiêu thụ khoảng 45 triệu tấn clo. Nếu dùng muối ăn để điều chế clo thì cần bao nhiêu tấn muối (Giả thiết hiệu suất phản ứng đạt 100%) ?
A. 74 triệu tấn. B. 74,15 triệu tấn.
C. 74,51 triệu tấn. D. 74,14 triệu tấn.
Lời giải:
Đáp án A.
2NaCl + 2H2O → Cl2 + H2 +2NaOH
90/71 ← 45/71 (mol)
mNaCl = 90/71.(23 + 35,5) = 74,15 (tấn)
Bài 39: Cho các phản ứng sau:
(1). Cl2 + 2NaBr → 2NaCl + Br2 (2). Br2 + 2NaI → 2NaBr + I2
(3). Cl2 + 2NaF → 2NaCl + F2 (4). Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(5). F2 + 2NaCl → 2NaF + Cl2 (6). HF + AgNO3 → AgF + HNO3
(7). HCl + AgNO3 → AgCl + HNO3 (8). PBr3 + 3H2O → H3PO3 + 3HBr
Số phương trình hóa học viết đúng là :
A. 6. B. 7. C. 5. D. 8.
Lời giải:
Đáp án C
Các phương trình viết đúng là:
(1). Cl2 + 2NaBr → 2NaCl + Br2
(2). Br2 + 2NaI → 2NaBr + I2
(7). HCl + AgNO3 → AgCl + HNO3
(4). Br2 + 5Cl2 + 6H2O → 2HBrO3 + 10HCl
(8). PBr3 + 3H2O → H3PO3 + 3HBr
Các phản ứng viết sai là:
(3). Cl2 + 2NaF → 2NaCl + F2 vì tính oxi hóa của Cl2 yếu hơn Flo.
(5). F2 + 2NaCl → 2NaF + Cl2 vì Flo có tính oxi hóa rất mạnh nó oxi hóa được H2O.
(6). HF + AgNO3 → AgF + HNO3 vì AgF là chất tan.
Bài 40: Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm thể tích của clo trong Y là
A. 40% B. 50% C. 60% D. 70%
Lời giải:
Đáp án A
Ta có mX + mY = mZ ⇒ 7,8 + mY = 19,7
mY = 11,9 (g)
Gọi nCl2 = x mol; nO2 = y mol
Ta có x + y = 5,6/22,4 = 0,25 mol (1)
mCl2 + mO2 = 71x + 32y = 11,9 (2)
Giải (1) và (2) ta có x = 0,1 (mol); y = 0,15(mol)
%VO2 = 0,1/0,25 . 100% = 40%
Bài 41: Cho 12,1 g hỗn hợp Zn, Fe tác dụng với vừa đủ với m g dd HCl 10%. Cô cạn dd thu được 19,2 g muối. Giá trị m là:
A. 73 g B. 53 g C. 43 g D. 63 g
Lời giải:
Đáp án A.
mmuối = mKL + mgốc axit
⇒ 19,2 = 12,1 + mCl-
mCl- = 7,1
⇒nCl- = 0,2 mol = nHCl
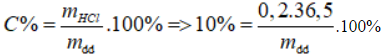
⇒ m = 73 g
Bài 42: Có 5 gói bột tương tự nhau là CuO, FeO, MnO2, Ag2O, (Fe + FeO). Có thể dùng dung dịch nào trong các dung dịch nào dưới đây để phân biệt 5 chất trên ?
A. HNO3. B. AgNO3. C. HCl. D. Ba(OH)2.
Lời giải:
Đáp án C.
| CuO | FeO | MnO2 | Ag2O | Fe+FeO | |
| Dung dịch HCl | Dd xanh lam | Dd không màu | Khí màu vàng nhạt | Kết tủa trắng | Khí không màu |
CuO + 2HCl → CuCl2 + H2O
FeO + 2HCl → FeCl2 + H2O
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Ag2O + 2HCl → 2AgCl + H2O
Fe + 2HCl → FeCl2 + H2
Bài 43: Hoà tan 9,14 g hỗn hợp Cu, Mg, Al bằng một lượng vừa đủ dd HCl được 7,84 lít khí H2¬ (đktc) và 2,54 g rắn Y và dd Z. Cô cạn dd Z thu được khối lượng muối khan là:
A. 31,45 g B. 33,25 g C. 39,9 g D. 35,58 g
Lời giải:
Đáp án A
Chất rắn Y là Cu không phản ứng.
nHCl = 2nH2 = 2. 7,84/22,4 = 2. 0,35 = 0,7 mol
mmuối = mKL + mgốc axit = (9,14 – 2,54) + 0,7.35,5 = 31,45(g)
Bài 44: Cho 5,85 gam muối NaX tác dụng với dd AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X(x1%) và 37X(x2%). Vậy giá trị của x1% và x2% lần lượt là:
A. 25% & 75% B. 75% & 25% C. 65% & 35% D. 35% & 65%
Lời giải:
Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 ⇒ X :35,5(Cl)
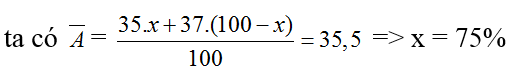
Bài 45: Cho 3 lít Cl2 phản ứng với 2 lít H2; hiệu suất phản ứng đạt 80%. Phần trăm thể tích Cl2 trong hỗn hợp khí sau phản ứng là (các thể tích khí được đo ở cùng điều kiện to, p)
A. 28%. B. 64%. C. 60%. D. 8%.
Lời giải:
Đáp án A.
Các thể tích đo trong cùng điều kiện nhiệt độ và áp suất, nên thể tích cũng là số mol.
H2 + Cl2 → 2HCl
Ban đầu 2 3
Phản ứng 2.0,8 1,6 3,2
Sau phản ứng 0,4 1,4 3,2
=&gct; nsau phản ứng = 0,4 + 1,4 + 3,2 = 5.
%VCl2 = 1,4/5 .100% = 28%
Bài 46: Hỗn hợp X gồm Zn , Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp là
A. 8,4 g. B. 11,2 g. C. 2,8 g. D. 5,6 g.
Lời giải:
Đáp án D.
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3).
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g
Bài 47: Hòa tan hoàn toàn 2,45g hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại kiềm thổ đó là
A. Be và Ca. B. Mg và Ca. C. Be và Mg. D. Mg và Sr.
Lời giải:
Đáp án A.
Gọi A, B là kí hiệu của 2 kim loại.
X là kí hiệu chung của 2 kim loại.
Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên nACl2 = nBCl2 = a
TH1: Nếu dung dịch chỉ chứa 2 muối
A + 2HCl → ACl2 + H2
a 2a a a
B+ 2HCl → BCl2 + H2
a 2a a a
nHCl = 0,2 × 1,25 = 0,25
⇒ 4a = 0,25 ⇒ a = 0,0625 mol
MA,B = 2,45/2a = 19,6
M(Be) = 9 < 19,6 < MB
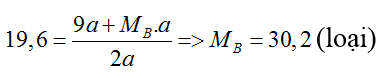
TH2: Vậy dung dịch sau phản ứng có HCl dư
nACl2 = nBCl2 = nHCl = a
⇒ nHCl(bđ) = 0,25 = 4a + a = 5a
⇒ a = 0,05
MA,B = 2,45/2a = 24,5
Nếu A là Be ⇒ MA = 9
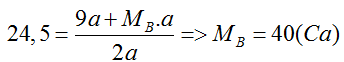
Vậy 2 kim loại là Be và Ca
Bài 48: Chất A là muối Canxi halogenua. Dung dịch chứa 0,200 gam A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 gam kết tủa bạc halogenua. Công thức phân tử của chất A là
A. CaF2. B. CaCl2. C. CaBr2. D. CaI2.
Lời giải:
Đáp án C.
Gọi công thức muối là CaX2
CaX2 + 2AgNO3 → Ca(NO3)2 +2AgX
40+2X 2.(108+X)
0,2 0,376
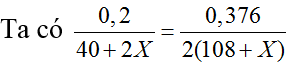
→ X=80 (Br)
Công thức. CaBr2
Bài 49: Cho các sơ đồ phản ứng :
Zn + HCl → Khí A + ... KMnO4 + HCl → Khí B + ...
KMnO4 to→ Khí C + ...
Các khí sinh ra (A, B, C) có khả năng phản ứng với nhau là :
A. A và B, B và C. B. A và B, A và C.
C. A và C, B và C. D. A và B, B và C, A và C.
Lời giải:
Đáp án B.
Zn + 2HCl → ZnCl2 + H2 (A)
KMnO4 + HCl → KCl + MnCl2 + H2O + Cl2 (B)
2KMnO4 to→ K2MnO4 + MnO2 + O2(C)
Bài 50: Nguyên tử nguyên tố X tạo ion X-. Tổng số hạt (p, n, e) trong X- bằng 116. X là nguyên tử nguyên tố nào dưới đây?
A. 34Se B. 32Ge C. 33As D. 35Br
Lời giải:
Đáp án D.
X- có tổng số hạt bằng = 116, vậy X có tổng số hạt = 115.
Ta có
2p + n = 115 ⇒ n = 115 – 2p, thay vào (1) ta có
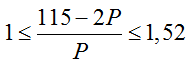
↔ P ≤ 115 – 2P ≤ 1,52P
Giải ra ta có p = n =35 (Br)
Bài 51: Khi clo tác dụng với kiềm đặc nóng, tạo muối clorat thì có một phần clo bị khử, đồng thời một phần clo bị oxi hóa. Tỉ lệ số nguyên tử clo bị khử và số nguyên tử clo bị oxi hóa là:
A. 1 : 1 B. 3 : 1 C. 1 : 5 D. 5 : 1
Lời giải:
Đáp án D.
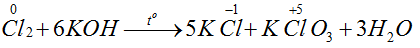
Bài 52: Khối lượng HCl bị oxi hóa bởi MnO2 là bao nhiêu, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được 12,7g I2 từ dung dịch NaI.
A. 3,65 B. 7,3 C. 14,6 D. 36,5
Lời giải:
Đáp án B.
Phương trình hóa học của phản ứng;
Cl2 + 2NaI → 2NaCl + I2
0,05 ← 0,05 (mol)
nIot = 0,05 mol.
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
0,2 ← 0,05 (mol)
Khối lượng HCl cần dùng là: mHCl = 0,2 x 36,5 = 7,3g.
Bài 53: Phát biểu nào không đúng?
A. Tính oxi hoá giảm dần: Flo > Clo > Brom > Iot
B. Tính axit giảm dần: HF > HCl > HBr > HI
C. Tính axit giảm dần: HClO4 > HBrO4 > HIO4
D. HClO4 là axit mạnh.
Lời giải:
Đáp án B.
Tính axit tăng dần: HF < HCl < HBr < HI
Bài 54: Chọn câu đúng khi nói về flo, clo, brom, iot:
A. Flo có tính oxi hóa rất mạnh, oxi hóa mãnh liệt nước.
B. Clo có tính oxi hóa mạnh, oxi hóa được nước.
C. Brom có tính oxi hóa mạnh, nhưng yếu hơn flo và clo, nó cũng oxi hóa được nước.
D. Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng cũng oxi hóa được nước.
Lời giải:
Đáp án A.
Bài 55: Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% ( D = 1,19 g/ml ) thu được 0,4 mol khí. Thành phần % về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là :
A. 61,6% và 38,4% B. 50,0% và 50,0%
C. 45,0% và 55,0% D. 40,0% và 60,0% .
Lời giải:
Đáp án A.
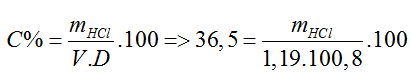
⇒ mHCl = 43,78 (g)
nHCl = 1,2 (mol)
Gọi nZn = a, nZnO = b.
Zn + 2HCl → ZnCl2 + H2
0,4 0,8 ← 0,4 (mol)
ZnO + 2HCl → ZnCl2 + H2O
0,2 ← 0,4 (mol)
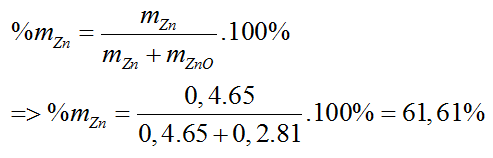
%mZnO = 100% -61,6% = 38,4%
Bài 56: Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%. B. 11,79%. C. 28,21%. D. 15,76%.
Lời giải:
Đáp án B.
Fe+ 2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
mFeCl2 = 127a, mMgCl2 = 95b, mH2 = 2(a + b)
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
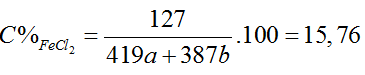
Giải PT ⇒ a = b
Bài 57: Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 0,75M. B. 1M. C. 0,25M. D. 0,5M.
Lời giải:
Đáp án D.
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525
⇒ KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M
Bài 58: Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị hai không đổi trong hợp chất) trong hỗn hợp khí X gồm Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M
A. Mg. B. Ca. C. Be. D. Cu.
Lời giải:
Đáp án A.
mrắn sau − mM = mX ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2)
Giải hệ (1) và (2) ⇒nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn e
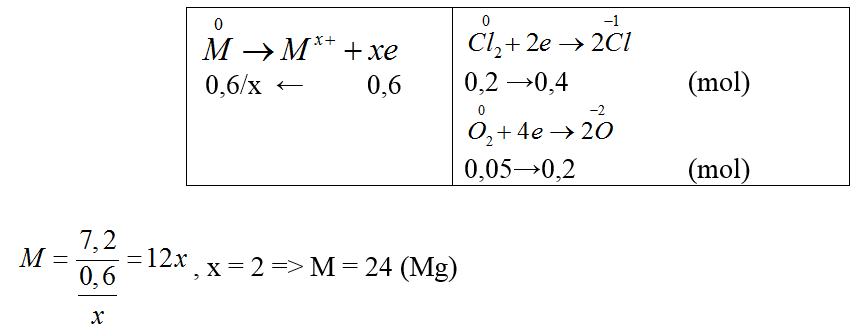
Bài 59: Cho các phản ứng sau
1. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
2. 6HCl + 2Al → 2AlCl3 + 3H2.
3. 2HCl + Fe → FeCl2 + H2.
4. 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
5. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 4. B. 2. C. 3. D. 1.
Lời giải:
Đáp án B.
Phương trình 2, 3
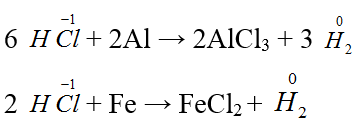

Bài 60: Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.
Lời giải:
Đáp án D.
TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a a
Áp dụng pp tăng giảm khối lượng
→ a = 0,03 (mol) → MNaZ= 201 → Z = 178
X và Y là I (127) và At (210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06 0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
Bài 61: Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
A. 0,48M. B. 0,24M. C. 0,4M. D. 0,2M.
Lời giải:
Đáp án B.
nCl2 = 0,6 mol, nKCl = 0,5 mol.
Phản ứng với KOH ở 100 độ C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O.
0,6 mol 0,5 mol
Từ PT ⇒ Cl2 dư nên số mol KOH tính theo số mol KCl
⇒ nKOH = 0,6 mol ⇒ CM(KOH)= 0,24 M
Bài 62: Hoà tan hoàn toàn 10,05 gam hỗn hợp 2 muối cacbonat kim loại hoá trị II vào dung dịch HCl thu được dung dịch A và 0,672 lít khí (đktc). Khối lượng muối trong A là
A. 10,38gam. B. 20,66gam. C. 30,99gam. D. 9,32gam.
Lời giải:
Đáp án A.
nCO2 = 0,03 mol
MCO3 + 2HCl → MCl2 + H2O + CO2
0,06 ← 0,03 0,03
Bảo toàn khối lượng
mmuối + mHCl = mmuối (A) + mCO2 + mH2O.
10,05 + 0,06.36,5 = mmuối (A) + 0,03.44 + 0,03.18 ⇒ m = 10,38 (g).
Bài 63: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là
A. 6,72. B. 8,40. C. 3,36. D. 5,60.
Lời giải:
Đáp án B
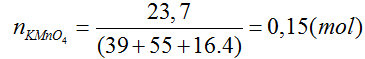
2KMnO4 + 16HCl → 5Cl2 + 8H2O + 2KCl + 2MnCl2
0,15 → 0,375
(mol)VCl2 = 0,375. 22,4 = 8,4l
Bài 64: Đốt 12,8 g Cu trong bình đựng khí clo. Thể tích khí clo (đktc) tham gia phản ứng là:
A. 4,48 B. 6,72 C. 2,24 D. 8,96
Lời giải:
Đáp án A.
nCu = 0,2 (mol)
Cu + Cl2 → CuCl2
0,2 → 0,2 (mol)
⇒ V = 0,2.22,4 = 4,48 (l)
Bài 65: Cho 11,3 gam hỗn hợp gồm Mg và Cu tác dụng hết với dung dịch HCl, thấy thoát ra 2,24 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 11,3 gam. B. 2,4 gam. C. 6,4 gam. D. 8,9 gam.
Lời giải:
Đáp án D
Chất rắn không tan là Cu.
nH2 = 0,1 (mol)
Mg + 2HCl → MgCl2 + H2
0,1 ← 0,1 (mol)
mMg = 0,1.24 = 2,4 (g)
⇒ mCu = 11,3 – 2,4 = 8,9 (g)
Bài 66: Cho 4,8 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 4,48 lít H2 (đktc). Kim loại đó là ?
A. Ba. B. Ca. C. Mg. D. Sr.
Lời giải:
Đáp án C
Gọi kim loại là R. nH2 = 0,2 (mol)
R + 2HCl → RCl2 + H2
0,2 ← 0,2 (mol)
MR = 4,8/0,2 = 24 (Mg)
Bài 67: Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg. B. Al. C. Fe. D. Zn.
Lời giải:
Đáp án B
Gọi n là hóa trị của M.
2M + nCl2 → 2MCln
Theo pt, nM = nmuối
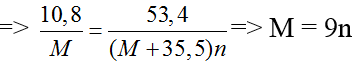
n = 1 ⇒ M = 9 (loại)
n = 2 ⇒ M = 18 (loại)
n = 3 ⇒ M = 27 (Al)
Bài 68: Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. Li và Na. B. Na và K. C. Rb và Cs. D. K và Rb
Lời giải:
Đáp án A.
Gọi hai kim loại kiềm là M−
2M− + 2HCl → 2MCl + H2
0,2 ← 0,1 (mol)
M− = 3,8/0,2 = 19 ⇒ 2 kim loại là Li(7) và Na (23).
Bài 69: Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
A. Dung dịch NaBr. B. Dung dịch NaI.
C. Dung dịch NaCl. D. Dung dịch H2SO4.
Lời giải:
Đáp án A.
Cl2 + 2NaBr → 2NaCl + Br2
Bài 70: Cho 300ml một dung dịch có hòa tan 5,85g NaCl tác dụng với 200ml dung dịch có hòa tan 34g AgNO3, người ta thu được một kết tủa và nước lọc. Nồng độ mol chất còn lại trong nước lọc là?. (Cho rằng thể tích nước lọc thu được không thay đổi đáng kể).
A. NaNO3 = 0,5M, AgNO3 = 0,3M B. NaNO3 = 0,3M, AgNO3 = 0,3M
C. NaNO3 = 0,5M, AgNO3 = 0,5M D. NaNO3 = 0,2M, AgNO3 = 0,2M
Lời giải:
Đáp án D.
nNaCl = 0,1 mol, nAgNO3 = 0,2 mol.
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
nAgNO3 (dư) = 0,2-0,1 = 0,1 (mol)
nNaNO3 = 0,1 mol
CAgNO3 = CNaNO3 = 0,1/0,5 = 0,2 mol
Bài 71: Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Lời giải:
Đáp án B
C% = mHCl/mdd .100% ⇒ 3,65 = mHCl/300 . 100
→ mHCl = 10,85 (g), nHCl = 0,3 (mol)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,05 ← 0,3 (mol)
X = 0,05.(27.2+16.3)=5,1(g)
Bài 72: Trong phản ứng:
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
A. 3/14. B. 4/7. C. 1/7. D. 3/7.
Lời giải:
Đáp án D
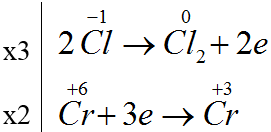
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl tham gia phản ứng = 6/14=3/7
Bài 73: Phản ứng nào sau đây chứng tỏ HCl có tính khử?
A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
B. HCl + Mg → MgCl2 + H2.
C. HCl + NaOH → NaCl + H2O.
D. 2HCl + CuO → CuCl2 + H2O.
Lời giải:
Đáp án A.
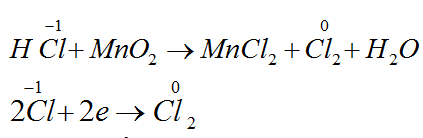
Bài 74: Đốt 3,36 gam kim loại M trong khí quyển clo thì thu được 9,75 gam muối clorua. Kim loại M là
A. Cu. B. Zn. C. Fe. D. Al.
Lời giải:
Đáp án C.
Gọi n là hóa trị của M.
2M + nCl2 → 2MCln
Theo pt, nM = nmuối
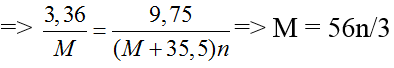
n = 1 ⇒ M = 56/3 (loại)
n = 2 ⇒ M = 112/3 (loại)
n = 3 ⇒ M = 56 (Fe)
Bài 75: Có các nhận xét sau về clo và hợp chất của clo
1. Nước Gia-ven có khả năng tẩy mầu và sát khuẩn.
2. Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển mầu hồng sau đó lại mất mầu.
3. Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4. Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl(màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
A. 2. B. 3. C. 4. D. 1
Lời giải:
Đáp án B.
Bài 76: Để chứng minh Cl2 vừa có tính khử vừa có tính oxi hóa, người ta cho Cl2 tác dụng với
A. Dung dịch FeCl2. B. Dây sắt nóng đỏ.
C. Dung dịch NaOH loãng. D. Dung dịch KI.
Lời giải:
Đáp án C.
Bài 77: Cho sơ đồ chuyển hoá:
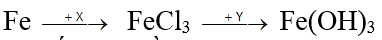
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là:
A. NaCl, Cu(OH)2. B. HCl, NaOH.
C. Cl2, NaOH. D. HCl, Al(OH)3.
Lời giải:
Đáp án C
2Fe + 3Cl2 → FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl.

Bài 78: Cho các phản ứng sau:
1. A + HCl → MnCl2 + B↑ + H2O 2. B + C → nước gia-ven
3. C + HCl → D + H2O 4. D + H2O → C + B↑+ E↑
Chất Khí E là chất nào sau đây?
A. O2. B. H2. C. Cl2O. D. Cl2.
Lời giải:
Đáp án B.
1. MnO2 + HCl → MnCl2 + Cl2 + H2O
2. Cl2 + 2NaOH → NaCl + NaClO + H2O
3. NaOH + HCl → NaCl + H2O
4. 2NaCl + 2H2O → 2NaOH + Cl2+ H2
Bài 79: Cho m gam một đơn chất halogen (X2) tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X2 là
A. F2 B. Cl2 C. Br2 D. I
Lời giải:
Đáp án B.
Mg + X2 → MgX2
2Al + 3X2 → 2AlX3
Bảo toàn nguyên tố X:
2nMgX2= 3nAlX3
⇒ 2.9,5/(24+2X)=3.8,9/(27+31X) ⇒ X = 35,5 (Cl)
Bài 80: Chỉ ra phát biểu sai :
A. Nước clo là dung dịch của khí clo trong nước.
B. Nước flo là dung dịch của khí flo trong nước.
C. Nước iot là dung dịch của iot trong nước.
D.Nước brom là dung dịch của brom trong nước.
Lời giải:
Đáp án B.
Do xảy ra phản ứng: 2F2 + 2H2O → 4HF + O2
Bài 81: Bệnh fuorosis (Bệnh chết răng) gây ảnh hưởng nghiêm trọng cho dân cư Ninh Hòa là do nguyên nhân nào sau đây?
A. Nguồn thực phẩm bị nhiễm độc thuốc trừ sâu
B. Nguồn nước bị ô nhiễm flo
C. Nước thải có hợp chất chứa oxi của clo vượt quá mức cho phép.
D. Người dân không sử dụng kem đánh răng.
Lời giải:
Đáp án B.
Bài 82: Việc ngưng sử dụng freon trong tủ lạnh và máy lạnh là do nguyên nhân nào sau đây
A. Freon phá hủy tầng ozon gây hại cho môi trường
B. Freon gây nhiễm độc nước sông, ao, hồ.
C. Freon gây độc cho người sử dụng máy lạnh, tủ lạnh.
D. Freon đắt tiền nên giá thành sản phẩm cao.
Lời giải:
Đáp án A.
Bài 83: Ứng dụng nào sau đây không phải của Clo?
A. Khử trùng nước sinh hoạt. B. Tinh chế dầu mỏ.
C. Tẩy trắng vải, sợi, giấy. D. Sản xuất clorua vôi, kali clorat.
Lời giải:
Đáp án B.
Bài 84: Trong tự nhiên, Clo tồn tại chủ yếu dưới dạng
A. NaCl trong nước biển và muối mỏ.
B. Khoáng vật sinvinit (KCl.NaCl).
C. Đơn chất Cl2 có trong khí thiên nhiên.
D. Khoáng vật cacnalit (KCl.MgCl2.6H2O).
Lời giải:
Đáp án A.
Bài 85: Khối lượng thuốc tím cần dùng để điều chế 4,48 lít khí clo là (biết H = 80%)
A. 12,64 gam B. 15,8 gam C. 12,64 gam D. 15,8 gam.
Lời giải:
Đáp án D.
nCl2 = 0,2 (mol)
16HCl +2KMnO4 → 2KCl + 2MnCl2+ 5Cl2
0,08 ← 0,2
Do H% = 80% ⇒ nKMnO4 = 0,08 . 100/80 = 0,1 mol
mKMnO4= 0,1.(39 + 55 + 16.4) = 15,8 (g)
Bài 86: Cho biết các phản ứng xảy ra sau:
(1) 2FeBr2 + Br2 → 2FeBr3
(2) 2NaBr + Cl2 → 2NaCl + Br2
Phát biểu đúng là:
A. Tính oxi hóa của Br2 mạnh hơn Cl2.
B. Tính khử của Cl- mạnh hơn của Br-.
C. Tính khử của Br- mạnh hơn Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn Fe3+.
Lời giải:
Đáp án D.
Từ phương trình (2) : 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1): FeBr2 + 1/2Br2 → FeBr3 nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Bài 87: Cho sơ đồ phản ứng sau:
R + 2HCl(loãng) → RCl2 + H2.
2R + 3Cl2 → 2RCl3.
Kim loại R là
A. Zn B. Al C. Mg D. Fe
Lời giải:
Đáp án B.
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Bài 88: Cho các phản ứng :
1. Cl2 + NaBr → NaCl + Br2
2. Cu + Cl2 → CuCl2
3. Cl2 + NaOH → NaCl + NaClO + H2O
4. Cl2 + 2FeCl2 → 2FeCl3
5. Cl2 + H2O ⇔ HCl + HClO
Số phản ứng Clo đóng vai trò làm chất oxi hóa là:
A. 5. B. 2. C. 3. D. 4.
Lời giải:
Đáp án C
Các phương trình 1,2,4.
Bài 89: Cho các chất X; Y; Z thỏa mãn sơ đồ phản ứng sau:
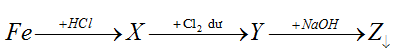
Các chất X và Z lần lượt là:
A.FeCl3, Fe(OH)3 B. FeCl2 và Fe2O3 C. FeCl2 và Fe(OH)2. D. FeCl2 và Fe(OH)3.
Lời giải:
Đáp án D.
Fe + 2HCl → FeCl2 + H2
FeCl2 + 1/2Cl2 → FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Bài 90: Điện phân một dd muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
A.Mg B. Fe C.Cu D.Ca
Lời giải:
Đáp án C.
nkhí = 0,25 (mol)
2MCln → 2M + nCl2
0,5/n ← 0,25 (mol)
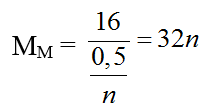
Với n = 2 ⇒ M = 64 (Cu)
Bài 91: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là (H% =60%)
A. 6,72 B. 8,40 C. 5,04 D. 5,60
Lời giải:
Đáp án C.
nKMnO4 = 23,7/158 = 0,15 mol
16HCl +2KMnO4 → 2KCl + 2MnCl2+ 5Cl2
0,15 → 0,375
Do H% = 60% ⇒ nCl2 = 0,375 . 60/100 = 0,225 mol
V = 0,225.22,4 = 5,04 (lít)

Bài 92: Cho sơ đồ chuyển hóa sau:
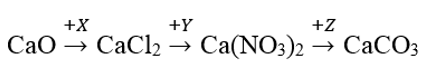
Công thức của X, Y, Z lần lượt là
A. Cl2, AgNO3, MgCO3 B. Cl2, HNO3, CO2
C. HCl, HNO3, NaNO3 D. HCl, AgNO3, (NH4)2CO3
Lời giải:
Đáp án D.
CaO + 2HCl → CaCl2 + H2O
CaCl2 + 2AgNO3 → 2AgCl + Ca(NO3)2
Ca(NO3)2 + Na2CO3 → CaCO3 + 2NaNO3
Bài 93: Khối lượng CaF2 cần dung để điều chế 400 gam dung dịch axit flohidric nồng độ 40% (hiệu suất phản ứng bằng 80%) là
A. 624 gam B. 312 gam C. 780 gam D. 390 gam
Lời giải:
Đáp án D.
C%HF = mHF/400 .100 = 40%
⇒ mHF =160 (g) ⇒ nHF = 8 (mol)
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60% ⇒ nCaF2 = 4. 100/80 = 5 mol
m = 5. (40+19.2) = 390 (g)
Bài 94: Điện phân hòa toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở đktc) ở anot. Kim loại trong muối là:
A.Na B.Ca C.K D.Mg
Lời giải:
Đáp án B.
nkhí = 0,02 (mol)
2MCln → 2M + nCl2
0,04/n ← 0,02 (mol)
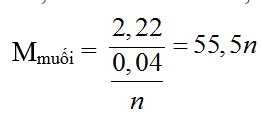
Với n = 2 ⇒ M = 40 (Ca)
Bài 95: Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là :
A. 2 lít. B. 2,905 lít. C. 1,904 lít. D. 1,82 lít.
Lời giải:
Đáp án C.
nMnO2 = 0,1 mol
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
0,1 → 0,1 (mol)
Do H% = 85%⇒ nCl2 = 0,1 . 85/100 = 0,085 mol
V = 0,085.22,4 = 1,904 (lít)
Bài 96: Cho dung dịch chứa 12,06 gam hỗn hợp gồm NaF và NaCl tác dụng với dung dịch AgNO3. Thu được 17,22 gam kết tủa. Thành phần phần trăm khối lượng của NaF trong hỗn hợp ban đầu là?
A. 47,2% B. 52,8% C. 58,2% D. 41,8%
Lời giải:
Đáp án D.
Kết tủa là AgCl.
AgNO3 + NaCl → AgCl + NaNO3
⇒ nNaCl = nAgCl = 17,22/143,5 = 0,12 (mol)
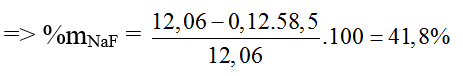
Bài 97: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 70,6. B. 61,0. C. 80,2. D. 49,3.
Lời giải:
Đáp án B.
nHCl = 1,2 (mol)
Oxit + 2HCl → Muối + H2O
1,2 → 0,6 (mol)
Bảo toàn khối lượng: moxit + m HCl = m muối + m nước
37,6 + 1,2.36,5 = m muối + 0,6.18
mmuối = 70,6 (g)
Bài 98: Hoà tan hỗn hợp gồm 0,2 mol Fe và 0,2 mol Fe3O4 bằng dung dịch HCl dư thu được dung dịch A. Cho A tác dụng với dung dịch NaOH dư, rồi lấy kết tủa nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là :
A. 74,2. B. 42,2. C. 64,0. D. 128,0.
Lời giải:
Đáp án C.
Ta có:
Fe + 2HCl → FeCl2 + H2
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
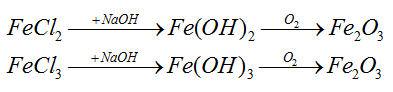
Bảo toàn Fe: nFe bđ = 0,2 + 0,2.3 = 0,8
2Fe → Fe2O3
0,8 → 0,4
⇒ m = 0,4.160 = 64 (g)
Bài 99: Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl thu được 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Vậy % theo khối lượng của từng chất trong hỗn hợp ban đầu lần lượt là :
A. 26%, 54%, 20%. B. 20%, 55%, 25%.
C. 19,4%, 50%, 30,6%. D. 19,4%, 26,2%, 54,4%.
Lời giải:
Đáp án D.
Chất rắn Y là Cu không phản ứng.
nH2 = 5,6 /22,4 = 0,25 mol
2Al + 6HCl → 2AlCl3 + 3H2
a 1,5a (mol)
Fe + 2HCl → FeCl2 + H2
b b (mol)
a có: 27a + 56b = 8,3
1,5a + b = 0,25 ⇒ a = b = 0,1 (mol)
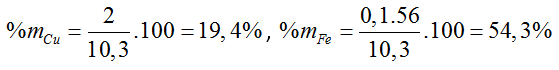
Bài 100: Hòa tan 9,6 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô cạn dung dịch, thu được 38 gam muối. Kim loại X là
A. canxi B. bari C. magie D. beri
Lời giải:
Đáp án C
M + 2HCl → MCl2 + H2 ↑
M M + 71
9,6 38