Tổng hợp Lý thuyết chương Nguyên tử - Hoá học lớp 10
Tổng hợp Lý thuyết chương Nguyên tử
Tài liệu Tổng hợp Lý thuyết chương Nguyên tử Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về chương Nguyên tử từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

Lý thuyết Luyện tập về: thành phần cấu tạo nguyên tử. Khối lượng của nguyên tử. Obitan nguyên tử
Lý thuyết Đồng vị. Nguyên tử khối và nguyên tử khối trung bình
Lý thuyết Sự chuyển động của electron trong nguyên tử. Obitan nguyên tử
Lý thuyết Năng lượng của các electron trong nguyên tử. Cấu hình electron nguyên tử
Lý thuyết Thành phần nguyên tử
I. Thành phần cấu tạo của nguyên tử
Nguyên tử có cấu tạo gồm:
- Hạt nhân ở giữa nguyên tử, gồm các hạt proton (p) (mang điện tích dương) và các hạt nơtron (n) (không mang điện).
- Vỏ nguyên tử gồm các hạt electron (e) (mang điện tích âm) chuyển động xung quanh hạt nhân.
| Hạt | Khối lượng (m) | Điện tích (q) | ||
| Thật | Tương đối | Thật | Tương đối | |
| Proton | 1,6726.10-27kg | 1u | +1,602.10-19C | 1+ |
| Nơtron | 1,6748.10-27kg | 1u | 0 | 0 |
| Electron | 9,1094.10-31kg | (1/1836)u | -1,602.10-19C | 1- |
* Kết luận:
+ Khối lượng nguyên tử bằng khối lượng hạt nhân nguyên tử đó (vì khối lượng của e rất bé so với khối lượng các hạt nơtron và proton, cụ thể 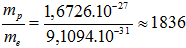
+ Nguyên tử trung hòa về điện, nên số p = số e.
II. Kích thước và khối lượng nguyên tử
a/ Kích thước nguyên tử: rất nhỏ, được tính bằng đơn vị nanomet (nm). 1 nm = 10-9m = 10 Å
| Đường kính | So sánh | |
| Nguyên tử | 10-1nm | 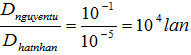
|
| Hạt nhân | 10-5nm | 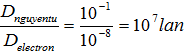
|
| Electron (hay proton) | 10-8nm | 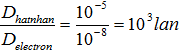
|
Vì vậy electron chuyển động xung quanh hạt nhân trong không gian rỗng của nguyên tử.
b/ Khối lượng nguyên tử: rất nhỏ, được tính bằng u (hoặc đvC).
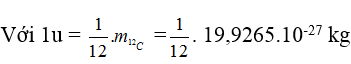
⇒ 1u = 1,6605.10-27kg.
Lý thuyết Hạt nhân nguyên tử - Nguyên tố hóa học
I. Hạt nhân nguyên tử
1/ Điện tích hạt nhân
Điện tích hạt nhân chính là tổng điện tích của proton.
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
Ví dụ: Nguyên tử Na có: Z =13 => Nguyên tử Na có 13 proton và 13 electron.
2/ Số khối
Số khối của hạt nhân bằng tổng số proton (Z) với tổng số nơtron (N).
A = Z + N
Ví dụ: Hạt nhân nguyên tử Nhôm có 13 proton và 14 notron.
⇒ Số khối A = 13 + 14 = 27
II. Nguyên tố hóa học
1/ Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
2/ Số hiệu nguyên tử
- Là số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố.
- Số hiệu nguyên tử cho biết:
+ Số proton trong hạt nhân nguyên tử
+ Số electron trong nguyên tử
+ Từ đó cũng xác định được số notron trong nguyên tử
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
N = A – Z (A là số khối, Z là số hiệu nguyên tử)
3/ Kí hiệu nguyên tử của nguyên tố X.
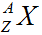
Trong đó:
A: Số khối
Z: Số hiệu nguyên tử
X: Kí hiệu hóa học của nguyên tố
Ví dụ: 168O ⇒ nguyên tử Oxi có số khối A = 16 và số hiệu nguyên tử Z = 8
....................................
....................................
....................................

