Phương pháp giải Các dạng bài tập chương Nguyên tử - Hoá học lớp 10
Phương pháp giải Các dạng bài tập chương Nguyên tử
Với Phương pháp giải Các dạng bài tập chương Nguyên tử Hoá học lớp 10 tổng hợp các dạng bài tập, bài tập trắc nghiệm có lời giải chi tiết với đầy đủ phương pháp giải, ví dụ minh họa sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Nguyên tử từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

- 4 dạng bài tập Nguyên tử Hóa 10 trong đề thi Đại học có lời giải
- Dạng 1: Xác định nguyên tố dựa vào số hạt
- Dạng 2: Xác định thành phần nguyên tử
- Dạng 3: Cách viết cấu hình electron
- Dạng 4: Bài tập lớp và phân lớp
- Dạng 5:
- Dạng 6: Trắc nghiệm lý thuyết về nguyên tử
- Dạng 7: Tính kích thước, khối lượng, khối lượng riêng, bán kính nguyên tử
Bài tập trắc nghiệm
- 40 bài tập trắc nghiệm chương Nguyên tử có đáp án
- 100 câu trắc nghiệm Nguyên tử có lời giải chi tiết (cơ bản)
- 100 câu trắc nghiệm Nguyên tử có lời giải chi tiết (nâng cao)
Xác định nguyên tố dựa vào số hạt
A. Phương pháp & Ví dụ
Nguyên tử của mỗi nguyên tố có một số Z đặc trưng nên để xác định nguyên tố ta cần xác định Z thông qua việc lập và giải phương trình về số hạt.
a) Dạng toán cơ bản cho 1 nguyên tử
Phương pháp:
- Căn cứ vào Z sẽ xác định được nguyên tử đó là thuộc nguyên tố hóa học nào
- Lưu ý: Z = số proton (p) = số electron (e) = E
Số khối: A = Z + N
Tổng số hạt = 2.Z + N
Tổng số hạt mang điện = Z + E = 2Z
Ví dụ 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Vậy X là
Hướng dẫn:
Ta có: 2.Z + N =82
2.Z - N=22
➢ Z = (82+22)/4 =26
➢ X là Fe
Công thức áp dụng nhanh: Z = (S + A )/4
Trong đó:
Z: số hiệu nguyên tử
S: tổng số hạt
A: Hiệu số hạt mang điện và không mang điện
b) Dạng toán áp dụng cho hỗn hợp các nguyên tử
Phương pháp:
Nếu là MxYy thì có thể coi có x nguyên tử M và y nguyên tử Y.
Do đó x.ZX + y.ZY = (Sphân tử + Aphân tử) / 4
Ví dụ 2: Tổng số hạt cơ bản trong phân tử X có công thức là M2O là 140, trong phân tử X thì tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Vậy X là
Hướng dẫn:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nên ta có : 2.ZM + 8 = (140 + 44) : 4 = 46 ⇒ Z =19
⇒ M là K ⇒ X là K2O
Áp dụng mở rộng công thức trên trong giải ion
➢ Nếu ion là Xx+thì ZX = (S + A+ 2x) / 4
➢ Nếu ion Yy-thì ZY = (S + A – 2y) / 4
Vậy khác biệt của công thức này với công thức ban đầu đó là thêm giá trị của điện ion
Cách nhớ: nếu ion dương thì đem + 2 lần giá trị điện ion dương, nếu âm thì – 2 lần giá trị điện ion âm)
Ví dụ 3: Tổng số hạt cơ bản của ion M3+ là 79, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 19. M là
Hướng dẫn:
ZM = (79 + 19 +2.3) : 4 = 26 ⇒ M là sắt (Fe).
c) Dạng toán cho tổng số hạt cơ bản
Phương pháp:
Với dạng này thì ta phải kết hợp thêm bất đẳng thức:
1 ≤ N/Z ≤ 1,52 (với 82 nguyên tố đầu bảng tuần hoàn)
1 ≤ (S −2Z)/Z ≤ 1,52 ⇒ S/3,52 ≤ Z ≤ S/3
Thường với 1 số nguyên tố đầu độ chênh lệch giữa p, n, không nhiều thường là 1 hoặc 2, nên sau khi chia S cho 3 ta thường chon luôn giá trị nguyên gần nhất.
Ngoài ra có thể kết hợp công thức:
S = 2Z + N = Z + (Z + N) hay là S =Z + A
Ví dụ 4: Tổng số hạt cơ bản của nguyên tử X là 52, X thuộc nhóm VIIA. X là
Hướng dẫn:
Z ≤ 52: 3 = 17,33 ⇒ Z là Clo (Cl)
ZM ≤ 60:3 = 20 ⇒ Ca, ZX ≤ 24 : 3 = 8 ⇒ O Vậy MX là CaO.
B. Bài tập trắc nghiệm
Câu 1. Cho nguyên tử X có tổng số hạt là 34, trong đó số hạt mang điện gấp 1,8333 lần số hạt không mang điện. Xác định số khối X?
A. 23 B. 24 C. 27 D. 11
Lời giải:
Đáp án: A
Ta có tổng số hạt trong nguyên tử: P + N + E = 34
Mà P = E = Z ⇒ 2Z + N = 34
Mặt khác số hạt mang điện gấp 1,8333 lần số hạt không mang điện nên:
2Z = 1,8333N ⇒ 1,8333N + N = 34 ⇒ N = 12 ⇒ Z = 11
Vậy X có Z = 11 nên điện tích hạt nhân là 11+
Số khối của X: A = Z + N = 23
Câu 2. Một nguyên tử nguyên tố A có tổng số proton, nơtron, electron là 52. Tìm nguyên tố A.
A. Mg B. Cl C. Al D. K
Lời giải:
Đáp án: B
Ta có: 2Z + N = 52
Do bài toán có hai ẩn nhưng chỉ có một dữ kiện để lập phương trình nên ta sử dụng thêm giới hạn
1 ≤ N/Z ≤ 1,222 hay 52/3,222 ≤ Z ≤ 52/3 ⇒ 16,1 ≤ Z ≤ 17,3.
Chọn Z = 17 ⇒ N = 18 ⇒ A = 35 (nguyên tố Clo)
Câu 3. Nguyên tử của nguyên tố X có tổng số hạt là 40 .Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là :
A. 27 B. 26 C. 28 D. 23
Lời giải:
Đáp án: A
p + n + e = 40 vì p = e ⇒ 2p + n = 40 (1)
Hạt mang điện: p + e = 2p
Hạt không mang điện: n.
Theo bài: 2p – n = 12 (2)
Từ 1 và 2 ⇒ p = e = 13; n = 14 ⇒ A = p + n = 27
Vậy, kim loại X là Ca, Y là Fe.
Câu 4. Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại X và Y là 142, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42. Số hạt mang điện của nguyên tử Y nhiều hơn của X là 12. Hai kim loại X, Y lần lượt là
A. Na, K. B. K, Ca. C. Mg, Fe. D. Ca, Fe.
Lời giải:
Đáp án: D
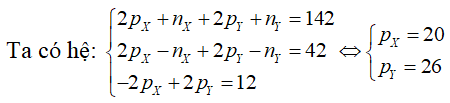
Câu 5. Tổng số hạt proton, nơtron và electron trong nguyên tử nguyên tố X là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. X là nguyên tố nào sau đây ?
A. Al B. Fe C. Cu D. Ag
Lời giải:
Đáp án: D
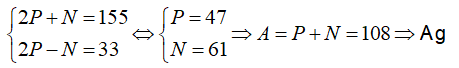
Câu 6. Một ion X3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hat mang điện nhiều hơn số hạt không mang điện là 19. Viết kí hiệu của nguyên tử X.
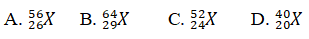
Lời giải:
Đáp án: A
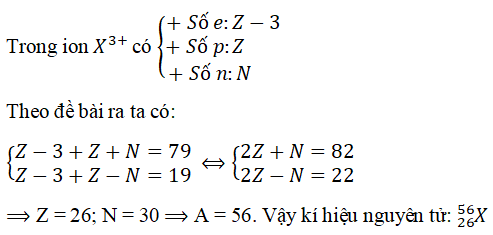
⇒ Z = 26; N = 30 ⇒ A = 56. Vậy ki hiệu nguyên tử: 2656)X
Câu 7. Tổng số các hạt trong nguyên tử M là 18. Nguyên tử M có tổng số hạt mang điện gấp đôi số hạt không mang điện. Hãy viết kí hiệu nguyên tử M.
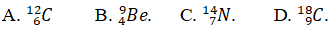
Lời giải:
Đáp án: A
Tổng số hạt trong nguyên tử : P + N + E = 18
Mà P = E = Z ⇒ 2Z + N = 18
Măt khác tổng số hạt mang điện gấp đôi số hạt không mang điện
2Z = 2N ⇒ Z = N = 6 ⇒ A = 12
Kí hiệu nguyên tử M: 612C.
Câu 8. Mỗi phân tử XY2 có tổng các hạt proton, nơtron, electron bằng 178; trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hoá học của X,Y lần lượt là
A. Fe và S B. S và O C. C và O D. Pb và Cl
Lời giải:
Đáp án: A
Kí hiệu số đơn vị điện tích hạt nhân của X là ZX , Y là ZY ; số nơtron (hạt không mang điện) của X là NX, Y là NY . Với XY2 , ta có các phương trình:
tổng số hạt của X và Y là: 2 ZX + 4 ZY + NX + 2 NY = 178 (1)
Số hạt mang điện nhiều hơn không mang điện là: 2.ZX + 4.ZY - NX – 2.NY = 54 (2)
Số hạt mang điện của X ít hơn số hạt mang điện của Y là: 4.ZY – 2.ZX = 12 (3)
ZY = 16 ; ZX = 26
Vậy X là sắt, Y là lưu huỳnh ⇒ XY2 là FeS2
Xác định thành phần nguyên tử
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Dựa vào kí hiệu nguyên tử ra suy ra số hạt mỗi loại trong nguyên tử hoặc dựa vào cấu tạo của nguyên tử, ion tương ứng để lập phương trình, giải phương trình tìm số hạt.
Lưu ý: Kí hiệu nguyên tử: ZAX
Sơ đồ: M → Mn+ + ne (với n là số electron do M nhường)
X + me → Xm- ( với m là số electron do X nhận)
Ví dụ minh họa
Ví dụ 1. Nguyên tử Ca có 20 notron, 20 proton. Số hiệu nguyên tử của Ca là:
A. 20 B. 16 C. 31 D. 30
Hướng dẫn:
Số hiệu nguyên tử Z chính là số proton.
Đáp án A
Ví dụ 2. Cho biết nguyên tử của nguyên tố A có tổng số hạt là 58, số khối của nguyên tử nhỏ hơn 40. Hãy xác định số proton, số nơtron, số electron trong nguyên tử.
Hướng dẫn:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3⇒ 18 ≤ Z ≤ 19,3 ⇒ Z = 18; Z = 19
Nếu Z = 18 ⇒ N = 22 ⇒ A = 40 (loại)
Nếu Z = 19 ⇒ N = 20 ⇒ A = 39 (nhận)
⇒ Nguyên tử A có 19p, 19e, 20n.
Ví dụ 3. Hạt nhân của nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Tính số electron trong A.
A. 12 B. 24 C.13 D. 6
Hướng dẫn:
Số khối A = Z + N =24
Biết N = 12 ⇒ E = Z = 24 - 12 = 12
Ví dụ 4. Nguyên tử X có ký hiệu 2964X. Số notron trong X là:
Hướng dẫn:
2964X ⇒ Z = 29, A = 64 nên N = A - Z = 64 - 29 = 35 hạt
B. Bài tập trắc nghiệm
Câu 1. Nguyên tử X có 35 proton, 35 electron, 45 notron. Số khối của nguyên tử X là:
A. 80 B.105 C. 70 D. 35
Lời giải:
Đáp án: A
Số khối A = Z + N = 35 + 45 = 80
Câu 2. Xác định số notron trong nguyên tử oxi biết O có 8 proton:
A.8 B. 16 C.6 D.18
Lời giải:
Đáp án: A
Số proton: Z = A – N = 16 – 8 = 8
Câu 3. Trong nguyên tử A, số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong A là bao nhiêu?
A. 13 B. 15 C. 27 D.14
Lời giải:
Đáp án: A
Số e = Số p = 13.
Câu 4. Trong anion X3- tổng số các hạt 111; số electron bằng 48% số khối. Tìm số proton, số electron, nơtron và tìm số khối A của X3-.
Lời giải:
Đáp án:
Từ X + 3e → X3-nên tổng số hạt trong X là: 111 – 3 = 108
Ta có 2Z + N = 108 (1)
Mặt khác do số electron bằng 48% số khối nên:
Z + 3 = 48%(Z + N) ⇔ 52Z + 300 = 48N hay 13Z + 75 = 12N (2)
Từ (1) và (2) ⇒ Z = 33; N = 42 ⇒ A = 33 + 42 =75
X + me → Xm- ( với m là số electron do X nhận)
Câu 5. Cho biết nguyên tử của nguyên tố A có tổng số hạt là 58, số khối của nguyên tử nhỏ hơn 40. Hãy xác định số proton, số nơtron, số electron trong nguyên tử.
Lời giải:
Đáp án:
Ta có: 2Z + N = 58
Kết hợp: 58/3,222 ≤ Z ≤ 58/3⇒ 18 ≤ Z ≤ 19,3 ⇒ Z= 18; Z = 19
Nếu Z = 18 ⇒ N = 22 ⇒ A = 40 (loại)
Nếu Z = 19 ⇒ N = 20 ⇒ A = 39 (nhận)
⇒ Nguyên tử A có 19p, 19e, 20n.
Câu 6. Tổng số hạt mang điện trong hợp chất AB là 40. Số hạt mang điện trong nguyên tử nguyên tử A nhiều hơn số hạt mang điện trong nguyên tử B là 8. Số proton của A và B lần lượt là
A. 22 và 18 B. 12 và 8 C. 20 và 8 D. 12 và 16
Lời giải:
Đáp án: B
Tổng số hạt mang điện trong hợp chất AB là 40 → 2pA + 2pB = 40
Số hạt mang điện trong nguyên tử nguyên tử A nhiều hơn số hạt mang điện trong nguyên tử B là 8 → 2pA - 2pB = 8
Giải hệ → pA = 12, pB = 8
Câu 7. Một ion X2+ có tổng số hạt proton, nơtron, electron là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Số hạt nơtron và electron trong ion X2+ lần lượt là
A. 36 và 27. B. 36 và 29 C. 29 và 36. D. 27 và 36.
Lời giải:
Đáp án: A
Giải hệ 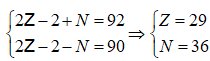
X có 29e thì nhường 2e được X2+ còn 27e , số notron không đổi
Câu 8. Xác định thành phần cấu tạo của các nguyên tử sau:
a. Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
b. Nguyên tử Y có tổng số các hạt là 36. Số hạt không mang điện thì bằng một nửa hiệu số giữa tổng số hạt với số hạt mang điện tích âm?
Lời giải:
Đáp án:
a) Gọi p, n và e lần lượt là số pronton, nơtron, và electron của X.
Theo đề bài, ta có hệ phương trình: 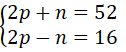
Giải hệ phương trình ta được: p = 17, n = 18.
Vậy trong X có: 17 electron và 18 nơtron.
b) Gọi p, n và e lần lượt là số pronton, nơtron, và electron của Y.
Theo đề bài, ta có hệ phương trình: 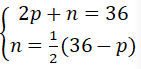
Giải hệ phương trình ta được: p = 12, n = 12.
Vậy trong X có: 12 proton,12 electron và 12 nơtron
Cách viết cấu hình electron
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Nắm chắc cách viết cấu hình electron nguyên tử dựa vào nguyên lý vững bền, nguyên lý Pauli và quy tắc Hund:
+ Nguyên lý Pauli: Trên một obital nguyên tử chỉ có thể chứa tối đa là hai electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các obital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
+ Nguyên lý vững bền: Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các obital có mức năng lượng từ thấp đến cao
* Các bước viết cấu hình electron nguyên tử
+ Xác định số electron trong nguyên tử.
+ Phân bố các electron theo trật tự mức năng lượng AO tăng dần.
+ Viết cấu hình electron theo thứ tự các phân lớp electron trong một lớp.
Ví dụ: 26Fe.
+ Có 26e
+ Viết theo trật tự mức năng lượng AO tăng dần:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
+ Sau đó viết lại theo thứ tự các phân lớp electron trong 1 lớp:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
+ Viết gọn: [Ar] 3d6 4s2
* Chú ý:
+ Trật tự các mức năng lượng AO tăng dần như sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
+ Dạng (n – 1)d4ns2 chuyển thành (n – 1)d5ns1
(n – 1)d9ns2 chuyển thành (n – 1)d10ns1
* Dựa vào số electron ở lớp ngoài cùng để suy ra tính chất của nguyên tố hóa học.
| Số electron lớp ngoài cùng | Tính chất của nguyên tố |
| 1, 2, 3 | Kim loại |
| 4 | Kim loại hoặc phi kim |
| 5, 6, 7 | Phi kim |
| 8 | Khí hiếm |
Sơ đồ hình thành ion nguyên tử:
M → Mn+ + ne
X + me → Xm-.
Ví dụ minh họa
Ví dụ 1: Cho biết số electron tối đa trong 1 lớp, 1 phân lớp
Hướng dẫn:
*Số electron tối đa trong một phân lớp
+ Phân lớp s chứa tối đa 2e
+ Phân lớp p chứa tối đa 6e
+ Phân lớp d chứa tối đa 10e
+ Phân lớp f chứa tối đa 14e
* Số electron tối đa trong một lớp
+ Lớp thứ nhất có tối đa 2e
+ Lớp thứ hai có tối đa 8e
+ Lớp thứ ba có tối đa 18e
Ví dụ 2: Nguyên tử X có ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của nguyên tố X có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố X có 30 nơtron trong hạt nhân.
(3) X là một phi kim.
(4) X là nguyên tố d.
Trong các phát biểu trên, những phát biểu đúng là?
A. (1), (2), (3) và (4).
B. (1), (2) và (4).
C. (2) và (4).
D. (2), (3) và (4).
Hướng dẫn:
Do có sự chèn mức NL nên electron được phân bố như sau:
1s22s22p63s23p6 4s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay [Ar] 3d64s2
- Số e lớp ngoài cùng là 2 do đó X là Kim loại
- N = A – Z = 56 – 26 = 30
- Electron cuối cùng phân bố trên phân lớp 3d nên X là nguyên tố d.
⇒ Chọn C.
Ví dụ 3: Cấu hình electron của nguyên tử nguyên tố X có dạng [Ne]3s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Hướng dẫn:
⇒ Chọn C.
Ví dụ 4: Cấu hình electron nào sau đây viết sai?
A. 1s22s22p5
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p64s24p5
D. 1s22s22p63s23p63d34s2
Hướng dẫn:
Cấu hình 1s22s2p63s23p64s24p5 thiếu phân lớp 3d. Trước khi electron được điền vào phân lớp 4p phải điền vào phân lớp 3d.
⇒ Chọn C.
Ví dụ 5: Một nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X. Viết cấu hình e của X
Hướng dẫn:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Ví dụ 6: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tổng số electron s và electron p của nguyên tố này là
Hướng dẫn:
Nguyên tố d có 4 lớp electron → electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dX4s2.
Vậy tổng số electron s và electron p là 20
B. Bài tập trắc nghiệm
Câu 1. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y
Lời giải:
Đáp án:
Nguyên tử của nguyên tố X có tổng số hạt electron tron các phân lớp p là 7
⇒ Cấu hình electron của nguyên tử X là: 1s2 2s2 2p6 3s2 3p1
⇒ ZX = 13 ⇒ X là Al
- Số hạt mang điện cảu một nguyên tử Y nhiều hơn số hạt mang điên của một nguyên tử X là 8 hạt ⇒ 2ZY - 2ZX = 8 ⇔ 2ZY – 2.13 = 8
⇒ ZY = 17 ⇒ Y là Cl
Câu 2. Nguyên tố X có Z = 28, cấu hình electron của ion X2+ là:
A. 1s22s22p63s23p64s23d8 B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p6 4s23d6 D. 1s22s22p63s23p63d8
Lời giải:
Đáp án: D
Cấu hình electron của X là 1s22s22p63s23p63d84s2
Cấu hình ion của X2+ là 1s22s22p63s23p63d8
Câu 3. Nguyên tử của nguyên tố X có electron ở mức năng lượng ở mức cao nhất là 3p. nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X va Y có số electron hơn kém nhau 3. Nguyên tử X, Y lần lượt là:
A. Khí hiếm và kim loại C. Kim loại và kim loại
B. Kim loại và khí hiếm D. Phi kim và kim loại
Lời giải:
Đáp án: D
Cấu hình e của Y: [Ne] 3s2 3p1 ⇒ Y là kim loại
Ta có: ZY = 13 ⇒ ZX = 11 ⇒ Cấu hình: [Ne] 3s1 (loại)
⇒ ZX = 15⇒ Cấu hình: [Ne] 3s2 3p3 ⇒ X là phi kim
Câu 4. Ion Xa+ có tổng số hạt là 80; số hạt mang điện nhiều hơn số hạt không mang điện là 20; tổng số hạt trong hạt nhân của ion Xa+ là 56. Hãy cho biết cấu hình electron đúng của Xa+?
A. [18Ar] 3d8 B. [18Ar] 3d6 C. [18Ar] 3d44s2 D. [18Ar] 3d4
Lời giải:
Đáp án: B
Ion Xa+ có tổng số hạt là 80 → 2p + n-a = 80
Ion Xa+ có số hạt mang điện nhiều hơn số hạt không mang điện là 20 → (2p-a) - n = 20
Ion Xa+ có tổng số hạt trong hạt nhân là 56 → p + n = 56
Giải hệ → p = 26, n = 30, a = 2
Cấu hình của Xa+ là [Ar]3d6.
Câu 5. Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
Lời giải:
Đáp án:
Cấu hình electron của A và B:
- Nguyên tố A có 3 trường hợp:
+ Không có electron ở 3d:
⇒ Cấu hình electron: 1s2 2s2 2p6 3s2 3p6 4s1: Z = 19 (K)
+ Có electon ở 3d: vì 4s1 chưa bão hòa nên:
hoặc 3d bán bão hòa: 1s2 2s2 2p6 3s2 3p6 3d5 4s1:Z = 24 (Cr)
hoặc 3d bão hòa: 1s2 2s2 2p6 3s2 3p6 3d10 4s1: Z = 29 (Cu)
- Nguyên tố B: 1s2 2s2 2p6 3s2 3p5, B có Z = 17 là clo (Cl)
Câu 6. Nguyên tử A có e ở phân lớp 3d chỉ bằng một nửa phân lớp 4s.Cấu hình electron của nguyên tử A là
A. [Ar]3d14s2 B. [Ar]3d44s2 C. [Ne]3d14s2 D. [Ar]3d34s2
Lời giải:
Đáp án: A
Số electron tối đa của phân lớp 4s là 4s2 → số e ở phân lớp 3d là 3d1
Cấu hình của nguyên tử A là [Ar]3d14s2
Câu 7. Nguyên tử M có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của M
A. 24 B. 25 C. 27 D. 29
Lời giải:
Đáp án: C
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27.
Câu 8. Viết cấu hình electron của các ion Cu2+, N3-, Fe3+, Cl-,Al3+. Biết số thứ tự nguyên tố lần lượt là: Cu (Z = 29), N (Z = 7), Fe (Z = 26), Cl (Z = 17), Al (Z = 13).
Lời giải:
Đáp án:
Cu2+ = 1s2 2s2 2p6 3s2 3p6 3d9
N3- = 1s2 2s2 2p6
Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5
Cl- = 1s2 2s2 2p6 3s2 3p6
Al3+ = 1s2 2s2 2p6

