Các dạng bài tập về H2S và muối sunfua - Hoá học lớp 10
Các dạng bài tập về H2S và muối sunfua
Với Các dạng bài tập về H2S và muối sunfua Hoá học lớp 10 gồm đầy đủ phương pháp giải, ví dụ minh họa và bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập H2S và muối sunfua từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Chú ý:
- S phản ứng với kim loại tạo muối sunfua của kim loại với hóa trị thấp.
- S có số oxi hóa 0 là số oxi hóa trung gian nên S thể hiện cả tính khử và tính oxi hóa còn S2- có số oxi hóa -2 là số oxi hóa thấp nhất của S nên H2S chỉ có tính khử.
- Tính tan của muối sunfua trong nước và trong axit:
+ Một số muối sunfua tan được trong nước: muối sunfua của kim loại nhóm IA như Na2S, K2S.
+ Một số muối sunfua không tan trong nước nhưng tan trong axit: ZnS, FeS, MgS...
+ Một số muối sunfua không tan trong axit: muối sunfua của kim loại nặng như: CuS, PbS ...
Ví dụ minh họa
Ví dụ 1. Có hai muối là natri hiđrosunfit và sắt sunfua. Cho hai muôi này tác dụng với axit HCl dư, thu được hai chất khí. Cho hai chất khí vừa thu được tác dụng với nhau, tạo thành 9,6 gam chất rắn. Tính khối lượng của NaHSO3 và FeS đã lấy để phản ứng. Biết hai khí tác dụng với nhau vừa đủ
Hướng dẫn:
Phản ứng:
NaHSO3 + HCl → NaCl + SO2 ↑ + H2O (1)
(mol) 0,1 ← 0,1
FeS + 2HCl → FeCl2 + H2S ↑ (2)
(mol) 0,2 ← 0,2
SO2+ 2H2S → 3S↓ + 2H2O (3)
(mol) 0,1 0,2 ← 0,3
Ta có: 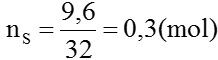
Từ (1) ⇒ nNaHSO3=0,1(mol)⇒ mNaHSO3=0,1×104=10,4(gam)
Từ (2) ⇒ nFeS=0,2(mol) ⇒ mFeS = 0,2 ×88 = 17,6 (gam)

Ví dụ 2. Đun nóng một hỗn hợp bột gồm 2,97 gam Al và 4,08 gam S trong môi trường kín không có không khí, được sản phẩm là hỗn hợp rắn A. Ngâm A trong dung dịch HCl dư, thu được hỗn hợp khí B.
a) Hãy viết phương trình hóa học của các phản ứng.
b) Xác định thành phần định tính và khối lượng các chất trong hỗn hợp A.
c) Xác định thành phần định tính và thể tích các chất trong hỗn hợp khí B ở điều kiện tiêu chuẩn.
Hướng dẫn:
Phản ứng:
2Al + 3S → Al2S3 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
Al2S3 _+ 6HCl → 2AlCl3 + 3H2S (3)
Số mol Al=0,11 (mol); Số mol S=0,1275 (mol)
⇒ nAl dư =0,015 mol
Hỗn hợp A gồm Al dư và Al2S3
Vậy: mAl=0,025 × 27=0,675(gam)
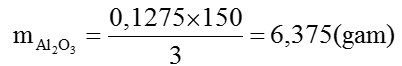
Hỗn hợp khí B gồm H2 và H2S
VH2= 1,5×0,025×22,4=0,84(lít)
VH2S=0,1275 ×22,4=2,856 (lít)
Ví dụ 3. Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3) 2 (dư), thu được 23,9 gam kết tủa đen.
a) Viết các phương trình hóa học của phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Thể tích mỗi khí là bao nhiêu (đktc)?
c) Tính khối lượng của Fe và FeS có trong hỗn hợp ban đầu.
Hướng dẫn:
Các phản ứng xảy ra:
Fe + 2HCl → FeCl2 + H2 ↑ (1)
(mol) x → x
FeS + 2HCl → FeCl2 + H2 S ↑ (2)
(mol) y → y
H2 S + Pb(NO3 ) 2 → PbS↓+ 2HNO3 (3)
(mol) 0,1 ←0,1
Gọi x và y lần lượt là số mol của Fe và FeS
Ta có: nFeS =0,1(mol) và nkhí =0,11 (mol)
Hỗn hợp khí thu được gồm H2 và H2 S
Từ (3) ⇒ nH2 = y = nPbS = 0,1 mol (*)
Từ (1), (2) ta có: x + y=0,11 (**)
Từ (*) và (**)⇒ x=0,01; y=0,1
Vậy: VH2 =0,01 ×22,4=1,224(lít) ; VH2S =22,4 ×0,1=2,24(lít)
c) Từ (1) ⇒ nFe =nH2=0,01 (mol) ⇒ mFe = 0,01 ×56=0,56 (gam)
Từ (2) ⇒ nFeS = nH2S=0,1(mol) ⇒s mFeS = 0,1 ×88=8,8(gam)
Ví dụ 4. Đun nóng hỗn hợp 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh thu được hỗn hợp X. Cho hỗn hợp X phản ứng hoàn toàn với 500ml dung dịch HC1 thu được hỗn hợp khí A và dung dịch B. Biết H = 100%).
Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp (X).
Biết rằng cần phải dùng 125 ml dung dịch NaOH 0,1M để trung hòa HCl dư trong dung dịch B. Hãy tính nồng độ mol/l của dung dịch HCl đã dùng.
Hướng dẫn:
Tính phần trăm thể tích mỗi khí trong A
Ta có: nFe =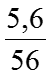
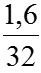
Phản ứng: Fe + S 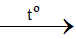
(mol) 0,05 ←0,05 → 0,05
Từ (1) ⇒ nFe : nS =1 : 1 và nFe = 0,1 ; nS=0,05 ⇒ Sau phản ứng (1) thì Fe còn dư
Fedư + 2HCl → FeCl2 + H2 ↑ (2)
(mol) 0,05 → 0,1 0,05
FeS + 2HCl → FeCl2 + H2 S ↑ (3)
(mol) 0,05 → 0,1 0,05
Từ (2), (3) ⇒ nH2= nH2S=0,05(mol)⇒%V H2S=50%
Ta có: nNaOH = 0,125 × 0,1=0,0125 (mol)
Phản ứng: HCl dư + NaOH → NaCl + H2 O (4)
(mol) 0,0125 ←0,0125
Từ (2), (3), (4) ⇒ ∑nHCl =0,1 +0,1 + 0,0125= 0,2125 (mol)
Vậy : 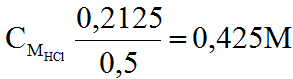
Ví dụ 5: Cho m gam hỗn hợp X gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,464 lít hỗn hợp khí Y (đktc). Cho hỗn hợp khí Y đi qua dung dịch Pb(NO3 ) 2 (dư) thu được 23,9g kết tủa màu đen.
a, Viết các phương trình phản ứng xảy ra
b, Tính thể tích mỗi khí trong Y và m
Trả lời:
nY = 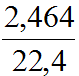
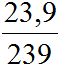
Fe + HCl → FeCl2 + H2
0,01 ← (0,11-0,1)
FeS + 2HCl → FeCl2 + H2S
0,1 ←0,1
H2S + Pb(NO3) 2 → PbS↓ + 2HNO3
0,1 ← 0,1
→ VH2S = 0,1 . 22,4 = 2,24 lít
VH2 = 0,01 . 22,4 = 0,224 lít
m = mFe + mFeS = 0,01. 56 + 0,1 . 88 = 9,36g
B. Bài tập trắc nghiệm

Câu 1. H2S bị oxi hóa thành lưu huỳnh màu vàng khi:
1) Dẫn khí H2S qua dung dịch FeCl3
2) Để dung dịch H2S ngoài trời
3) Đốt khí H2S ở điều kiện thiếu oxi
A. 1 và 2 B. 1 và 3 C. 2 và 3 D. 1, 2 và 3
Lời giải:
Đáp án: D
Các phương trình phản ứng xảy ra:
H2S + 2FeCl3 → 2FeCl2 + S↓ + 2HCl
2H2S + O2 → 2S↓ + 2H2O
Câu 2. Khẳng định nào sau đây đúng?
A. H2S chỉ có tính oxi hóa
B. H2S chỉ có tính khử
C H2S vừa có tính oxi hóa, vừa có tính khử tùy vào chất phản ứng với nó
D. H2S không có tính oxi hóa, cũng không có tính khử.
Lời giải:
Đáp án: B
Do số oxi hóa của S trong H2S là -2, đây là số oxi hóa thấp nhất. Nên H2S chỉ có khả năng nhường e → thể hiện tính khử
Câu 3. Dẫn a mol khí H2S vào dung dịch chứa b mol NaOH. Để thu được muối trung hòa thì:
A. a/b > 2 B. b/a > 2 C. b/a ≥ 2 D. 1 < b/a < 2
Lời giải:
Đáp án: C
Xét phương trình phản ứng: 2NaOH + H2S → Na2S + 2H2O → b/a ≥ 2
Câu 4. H2S bị oxi hóa thành khí SO2 khi:
A. Đốt khí H2S ở nhiệt độ cao và có dự oxi
B. Đốt khí H2S ở nhiệt độ cao.
C. Đốt khí H2S ở điều kiện thiếu oxi
D. Cho H2S đi qua dung dịch Ca(OH)2
Lời giải:
Đáp án: A
2H2S + 3O2 → 2SO2 + 2H2O

Câu 5. Cho a gam hỗn hợp gồm FeS2 và FeCO3 với số mol bằng nhau vào một bình kín chứa lượng dự oxi. Áp suất trong bình là p1 atm. Đun nóng bình để phản ứng xảy ra hoàn toàn rồi đưa bình và nhiệt độ ban đầu, áp suất khí trong bình lúc này là p2 atm, khối lượng chất rắn thu được là b gam. Biết rằng thể tích chất rắn trong bình trước và sau phản ứng là không đáng kể. Hãy xác định các tỉ số p1/p2 và a/b.
Lời giải:
Đáp án:
Trong a gam hỗn hợp gồm x mol FeCO3 và x mol FeS2
Các phương trình phản ứng đốt cháy:

Câu 6. Cho 20,8 gam hỗn hợp FeS và FeS2 vào bình kín chứa không khí dư. Nung nóng bình để phản ứng xảy ra hoàn toàn. Sau phản ứng ta thấy số mol khí trong bình giảm 0,15 mol. Thành phần % theo khối lượng của hỗn hợp FeS và FeS2 là:
A. 42,3 và 57,7% B. 50% và 50%
C. 42,3% và 59,4% D. 30% và 70%
Lời giải:
Đáp án: A
Các phản ứng xảy ra:
4FeS + 7O2 → 2Fe2O3 + 4SO2
4x 7x 4x
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
4y 11y 8y
Số mol khí giảm = số mol khí pư – số mol khí tạo thành
→ 7x + 11y – (4x + 8y) = 0,15 ↔ 3x + 3y = 0,15 (1)
Theo đề bài: 88 × 4x + 120 × 4y = 20,8 (2)
→ x = y = 0,025
%FeS = (88 × 4x)/20,8 × 100% = 42,3%
Câu 7. Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69% B. 95,00% C. 25,31% D. 64,68%
Lời giải:
Đáp án: A
m (g) 0,95m (g) → hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKH ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3m (mol)
→ %PbS (đã bị đốt cháy) = (3,125.10-3 m.239.100% )/m = 74,69%

Câu 8. Cho m gam hỗn hợp bột Fe và S với tỉ lệ số mol sắt bằng 2 lần số mol lưu huỳnh rồi đem nung nóng không có oxi, thu được hỗn hợp A. Hòa tan A bằng dung dịch HCl dư thu được 0,4 gam chất rắn B, dung dịch X và khí D. Sục khí D từ từ qua dung dịch CuCl2 dư thấy tạo ra 4,8 gam kết tủa đen.
a) Tính hiệu suất phản ứng tạo thành hỗn hợp A (theo S). Tính m.
b) Cho dung dịch X tác dụng với H2SO4 đặc, nóng dư. Tính thể tích khí thoát ra ở điều kiện tiếu chuẩn.
Lời giải:
Đáp án:
a) Gọi x là số mol S có trong m gam hỗn hợp
Suy ra số mol Fe sẽ là 2x.
Gọi x1 là số mol S tham gia phản ứng khi nung:
Ta có: Fe + S → FeS (1)
x1 x1 x1 mol
Sau khi nung, trong hỗn hợp A có:
(x – x1) mol S
(2x – x1) mol Fe
Và x1 mol FeS
- Hòa tan A trong axit HCl dư:
Fe + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
Còn lại 0,4g chất rắn B là lưu huỳnh dư
ns = x – x1 = 0,4/32 = 0,0125 mol (I)
Dung dịch C gồm HCl dư và FeCl2 với số mol là 2x. Khí D gồm H2 và H2S
Sục khí D từ từ vào dung dịch CuCl2 dư, chỉ có H2S phản ứng:
CuCl2 + H2S → CuS↓ + 2HCl (4)
Kết tủa đen tạo thành là CuS.
Theo (1), (2), (4):
nCuS = x1 = 4,8/96 = 0,05 mol (II)
Kết hợp (I) và (II) ta có: x – x1 = 0,0125
x = 0,0125 + 0,05 = 0,0625
- Hiệu suất phản ứng tạo thành hỗn hợp A:
Theo S: h% = 0,05/0,0625 × 100% = 80%
b) Dung dịch C gồm HCl dư và FeCl2 với số mol là 0,125. Cho dung dịch C tác dụng với H2SO4 đặc, nóng dư chỉ có FeCl2 phản ứng.
2FeCl2 + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4HCl + 2H2O
2 1 mol
0,125 x = 0,125.1/2 = 0,0625
→ VSO2 = 0,0625.22,4 = 1,4l

