Bài tập về Axit clohidric HCl cực hay, có lời giải chi tiết - Hoá học lớp 10
Bài tập về Axit clohidric HCl cực hay, có lời giải chi tiết
Với Bài tập về Axit clohidric HCl cực hay, có lời giải chi tiết Hoá học lớp 10 tổng hợp 30 bài tập trắc nghiệm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm dạng bài tập Axit clohidric HCl từ đó đạt điểm cao trong bài thi môn Hoá học lớp 10.

Câu 1: Chất nào sau đây có tên gọi là hiđroclorua?
A. dd HCl. B. khí Cl2.
C. khí HCl. D. dd HClO.
Lời giải:
Đáp án C
Hiđroclorua là HCl ở trạng thái khí.
Câu 2: Trộn dd chứa 1 g HCl vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu gì?
A. Màu đỏ. B. Màu xanh.
C. Không màu. D. Màu tím.
Lời giải:
Đáp án A
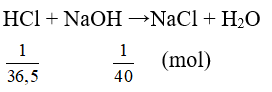
⇒ HCl dư, NaOH phản ứng hết ⇒ dung dịch làm quỳ tím chuyển sang màu đỏ.
Câu 3: Số oxi hóa của Cl trong HCl là
A. +1. B. -1.
C. 0. D. -2.
Lời giải:
Đáp án B
Gọi số oxi hóa của Cl là x → (+1) + x = 0 → x = -1.
Câu 4: Cho lượng dư dung dịch AgNO3 vào dung dịch hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Khối lượng kết tủa tạo thành là
A. 14,35 g. B. 10,8 g.
C. 21,6 g. D. 27,05 g.
Lời giải:
Đáp án A
NaF không phản ứng với AgNO3.
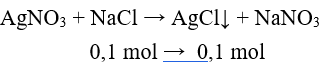
m↓ = 0,1.(108 + 35,5) = 14,35 (g).
Câu 5: Cho 0,3 gam một kim loại hóa trị II phản ứng hết với dung dịch HCl dư, thu được 0,28 lít H2 (đktc). Kim loại đó là?
A. Ba B. Ca.
C. Mg. D. Sr.
Lời giải:
Đáp án C
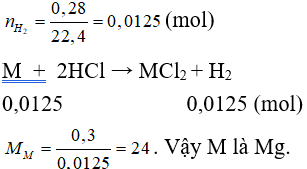
Câu 6: Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 g dd HCl 10%. Cô cạn dd thu được 13,15 g muối. Giá trị m là
A. 7,05 g. B. 5,3 g.
C. 4,3 g. D. 6,05 g.
Lời giải:
Đáp án D
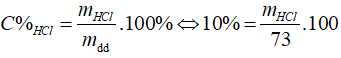
⇒ mHCl = 7,3 (g), nHCl = 0,2 (mol)
mmuối = mKL + mgốc axit = m + 0,2.35,5 = 13,15 ⇒ m = 6,05 (g)
Câu 7: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là
A. 6,4. B. 8,5.
C. 2,2. D. 2,0
Lời giải:
Đáp án D
Chất rắn không tan là Cu.
nH2 = 0,2 (mol)
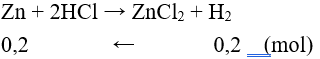
mZn = 0,2.65 = 13 (g) ⇒ mCu = 15 – 13 = 2 (g).

Câu 8: Cho 17,4 gam MnO2 tác dụng với dd HCl đặc, dư và đun nóng. Thể tích khí thoát ra (đktc) là
A. 4,48 lít. B. 2,24 lít.
C. 3,36 lít. D. 6,72 lít.
Lời giải:
Đáp án A
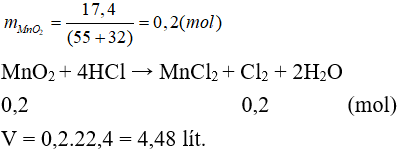
Câu 9: Kim loại tác dụng được với axit HCl loãng và khí clo cho cùng một loại muối clorua kim loại là:
A. Fe. B. Zn.
C. Cu. D. Ag.
Lời giải:
Đáp án B.
Cu, Ag không phản ứng với HCl.
2Fe + 3Cl2 → 2FeCl3; Fe + 2HCl → FeCl2 + H2
Zn + Cl2 → ZnCl2; Zn + 2HCl → ZnCl2 + H2.
Câu 10: Cho 10,5g hỗn hợp bột Mg, Fe tác dụng với dung dịch HCl dư thấy có 0,4g khí H2 bay ra. Khối lượng muối thu được sau phản ứng là
A. 17,6g B. 25,1g
C. 24,7g D. 17,8g
Lời giải:
Đáp án C
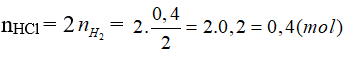
mmuối = mKL + mgốc axit = 10,5 + 0,4.35,5 = 24,7 (g).
Câu 11: Trong muối NaCl có lẫn NaBr và NaI. Để loại hai muối này ra khỏi NaCl người ta có thể
A. nung nóng hỗn hợp.
B. cho hỗn hợp tác dụng với dung dịch HCl đặc.
C. cho hỗn hợp tác dụng với Cl2 sau đó đun nóng.
D. cả A, B và C.
Lời giải:
Đáp án C
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Câu 12: Hòa tan 12,8 gam hỗn hợp gồm Fe, FeO bằng dd HCl vừa đủ, thu được 2,24 lít (đktc). Thành phần phần trăm theo khối lượng của FeO trong hỗn hợp là
A. 56,25% B. 43,75%
C. 66,67% D. 33,33%
Lời giải:
Đáp án A
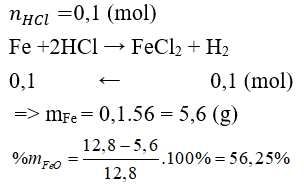
Câu 13: Trong các phản ứng sau, phản ứng nào sai?
A. Cu(OH)2 + 2HCl → CuCl2 + 2H2O.
B. Cu + 2HCl → CuCl2 + H2.
C. CuO + 2HCl → CuCl2 + H2O.
D. AgNO3 + HCl → AgCl + HNO3.
Lời giải:
Đáp án B
Cu đứng sau H trong dãy hoạt động của kim loại, do đó Cu không tác dụng với HCl.
Câu 14: Để trung hoà 100 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu?
A. 0,5 lít. B. 0,4 lít.
C. 0,3 lít. D. 0,6 lít.
Lời giải:
Đáp án C
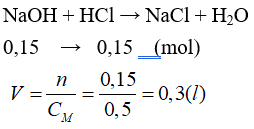
Câu 15: Đổ dung dịch AgNO3 vào dung dịch axit nào sau đây sẽ thu được kết tủa trắng?
A. HF B. HBr
C. HI D. HCl
Lời giải:
Đáp án D
AgNO3 + HCl → AgCl (↓ trắng) + HNO3.

Câu 16: Để nhận biết ion clorua, người ta dùng
A. NaNO3 B. NaCl
C. AgCl D. AgNO3
Lời giải:
Đáp án D
Ag+ + Cl- → AgCl (↓ trắng).
Câu 17: Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 1,0M. B. 0,25M.
C. 0,5M. D. 0,75M.
Lời giải:
Đáp án A
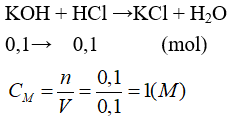
Câu 18: Cho 5,3 gam Na2CO3 vào dung dịch HCl (loãng, dư), sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 3,36 B. 2,80
C. 2,24 D. 1,12
Lời giải:
Đáp án D
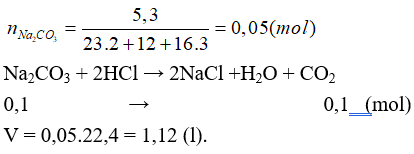
Câu 19: Trong dãy các chất sau đây, dãy các chất nào tác dụng với dung dịch HCl?
A. AgNO3, MgCO3, BaSO4, MnO2
C. Fe2O3, MnO2, Cu, Al
B. Fe, CuO, BaO, MnO2
D. CaCO3, H2SO4, Mg(OH)2, MnO2
Lời giải:
Đáp án B
A loại BaSO4, C loại Cu, D loại H2SO4.
Fe + 2HCl → FeCl2 + H2
CuO + 2HCl → CuCl2 + H2O
BaO + 2HCl → BaCl2 + H2O
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Câu 20: Cho các chất sau : NaOH (1), Zn (2), Ag (3), Al(OH)3 (4), Na2SO4 (5). Axit HCl tác dụng được với các chất nào ở ngay điều kiện thường?
A. (1), (2), (4). B. (3), (4), (5).
C. (1), (2), (3), (4). D. (1), (2), (3).
Lời giải:
Đáp án A
(1) HCl + NaOH → NaCl + H2O
(2) Zn + 2HCl → ZnCl2 + H2
(4) Al(OH)3 + 3HCl → AlCl3 + 3H2O.
Câu 21: Phản ứng hóa học nào không đúng ?
A. NaCl(rắn) + H2SO4(đặc)
B. 2NaCl(rắn) + H2SO4(đặc)
C. 2NaCl(loãng) + H2SO4(loãng) → Na2SO4 + 2HCl.
D. H2 + Cl2
Lời giải:
Đáp án C
Không thoả mãn điều kiện xảy ra phản ứng trao đổi trong dung dịch.

Câu 22: Lấy 1 lít khí H2 cho tác dụng với 2 lít khí Cl2. Hiệu suất phản ứng là 80%. Thể tích hỗn hợp sau phản ứng là (giả sử các thể tích đo trong cùng điều kiện nhiệt độ và áp suất)
A. 3 lít. B. 4 lít.
C. 5 lít. D. Kết quả khác.
Lời giải:
Đáp án A.
Do trong cùng điều kiện nhiệt độ và áp suất, tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Giả sử H = 100%, ta có H2 hết, do đó hiệu suất phản ứng tính theo H2.

⇒ Vsau phản ứng = 0,2 + 1,2 + 1,6 = 3.
Câu 23: Cho 16,7 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IIA trong bảng tuần hoàn tác dụng hết với dung dịch HCl (dư), thấy thoát ra 6,72 lít khí H2 (ở đktc). Hai kim loại đó là (cho nguyên tử khối các nguyên tố nhóm IIA: Be = 9, Mg = 24, Ca = 40, Sr = 87, Ba = 137)
A. Ca và Sr. B. Sr và Ba.
C. Mg và Ca. D. Be và Mg.
Lời giải:
Đáp án A.
Kim loại nhóm IIA, có số oxi hóa = +2 trong hợp chất. Gọi X là kí hiệu chung của 2 kim loại
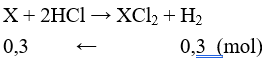
⇒ MX = 16,7 : 0,3 = 55,67
Ta có MCa = 40 < 55,67 < MSr = 88. Vậy hai kim loại là Ca và Sr.
Câu 24: Cho dung dịch A chứa 1,17g NaCl tác dụng với dung dịch B chứa 5,1g AgNO3 thu được m gam kết tủa. Giá trị của m là
A. 28,70g B. 43,05g
C. 2,87g D. 4,31g
Lời giải:
Đáp án C
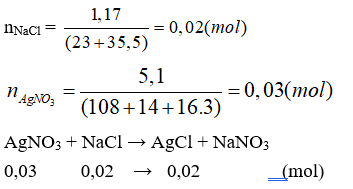
(Do AgNO3 dư, nên tính số mol sản phẩm theo NaCl).
mAgCl = 0,02.(108 + 35,5) = 2,87 (g).
Câu 25: Cho 0,515 gam muối natri halogenua (NaX) tác dụng hết với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa này sau phản ứng phân hủy hoàn toàn cho 0,54 gam Ag. Nguyên tố X là
A. brom. B. flo.
C. clo. D. iot.
Lời giải:
Đáp án A
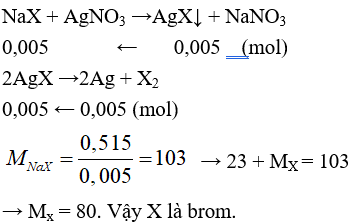
Câu 26: Cho các phản ứng sau:
a. 4HCl + MnO2
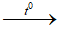
b. 2HCl + FeO → FeCl2 + H2O
c. HCl + NaOH → NaCl + H2O
d. 2HCl + Fe → FeCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 3. B. 4.
C. 2. D. 1.
Lời giải:
Đáp án D.
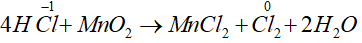
Số oxi hóa của Cl tăng từ -1 lên 0, do đó HCl thể hiện tính khử.
Câu 27: Cho phản ứng: NaX(rắn) + H2SO4(đậm đặc) → NaHSO4 + HX(khí)
Hiđro halogenua (HX) có thể điều chế theo phản ứng trên là
A. HCl. B. HBr.
C. HI D. cả A, B và C.
Lời giải:
Đáp án A.
HBr và HI có tính khử mạnh có thể phản ứng với H2SO4 đặc.

Câu 28: Cho 0,03 mol hỗn hợp NaX và NaY ( X, Y là hai halogen thuộc chu kì kế tiếp – đều tạo kết tủa với AgNO3) tác dụng với lượng dư dung dịch AgNO3 thu được 4,75 gam kết tủa. Công thức hai muối trên là
A. NaBr, NaI.
B. NaF, NaCl.
C. NaCl, NaBr.
D. NaF, NaCl hoặc NaBr, NaI.
Lời giải:
Loại B và D do NaF không tạo kết tủa với AgNO3
Gọi công thức chung của NaX và NaY là NaM.
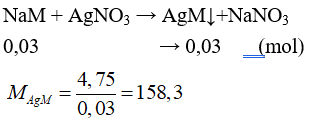
⇒ 108 + MM = 158,3 ⇒ MM = 50,3 ⇒ X,Y lần lượt là Cl và Br.
Câu 29: Cho các chất sau: Cu(OH)2 (1), ZnO (2), Ag (3), Al (4), KMnO4 (5), PbS (6), Na2CO3 (7), AgNO3 (8), MnO2 (9), ZnS (10). Axit HCl không tác dụng được với các chất
A. (1), (2). B. (3), (4).
C. (5), (6). D. (3), (6).
Lời giải:
Đáp án D
Ag đứng sau (H) trong dãy hoạt động hóa học của kim loại nên không phản ứng với HCl.
PbS là kết tủa không tan trong axit.
Câu 30: Hoà tan 1,12 lít khí HCl (đktc) vào m gam dung dịch HCl 16%, thu được dung dịch HCl 20%. Giá trị của m là
A. 36,5. B. 182,5.
C. 365,0. D. 224,0.
Lời giải:
Đáp án A.
nHCl = 0,05 (mol), mHCl thêm vào = 0,05. 36,5 = 1,825 (g)
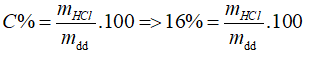
⇒ mHCl (trong dung dịch 16%) = 0,16mdd
Sau khi thêm 1,12 lít khí Cl2.
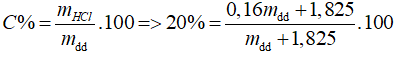
⇒ mdd = 36,5 (g)

