Tổng hợp Lý thuyết chương Tốc độ phản ứng và cân bằng hóa học - Hoá học lớp 10
Tổng hợp Lý thuyết chương Tốc độ phản ứng và cân bằng hóa học
Tài liệu Tổng hợp Lý thuyết chương Tốc độ phản ứng và cân bằng hóa học Hoá học lớp 10 sẽ tóm tắt kiến thức trọng tâm về Tốc độ phản ứng và cân bằng hóa học từ đó giúp học sinh ôn tập để nắm vứng kiến thức môn Hoá học lớp 10.

Lý thuyết Tốc độ phản ứng hóa học
I. Khái niệm về tốc độ phản ứng hóa học
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)... Tốc độ phản ứng được xác định bằng thực nghiệm.
2. Tốc độ trung bình
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
Ví dụ: Xét phản ứng aA → bB
Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít. Tốc độ trung bình của phản ứng là:
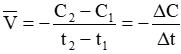
Còn nếu tính tốc độ phản ứng theo chất B thì tốc độ trung bình của phản ứng là:
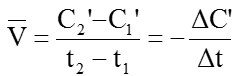
Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức:
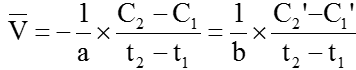
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
III. Ý nghĩa thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Ví dụ: Thực phẩm nấu trong nồi áp suất nhanh chín hơn khi nấu áp suất thường.
Các chất đốt như than, củi cháy nhanh hơn khi có kích thước nhỏ.
Lý thuyết Cân bằng hóa học
I. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
1. Phản ứng một chiều
- Phản ứng một chiều là phản ứng trong đó các sản phẩm phản ứng không tác dụng được với nhau để tạo ra các chất tham gia phản ứng.
Ví dụ:
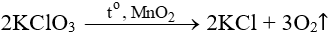
O2 tạo ra không tác dụng được với KCl để tạo thành KClO3.
2. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng trong đó các chất tham gia phản ứng tác dụng với nhau để tạo thành sản phẩm đồng thời các sản phẩm phản ứng được với nhau để tạo ra các chất tham gia phản ứng.
Ví dụ: 3H2 + N2 ⇋ 2NH3
NH3 được tạo thành đồng thời lại bị phân hủy sinh ra H2 và N2 là các chất tham gia phản ứng.
3. Cân bằng hóa học
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ của phản ứng nghịch.
II. Hằng số cân bằng
1. Cân bằng trong hệ đồng thể
Hệ đồng thể là hệ không có bề mặt phân chia trong hệ.
Ví dụ hệ gồm các chất khí, hệ gồm các chất tan trong dung dịch.
Xét phản ứng thuận nghịch trong hệ đồng thể:
aA + bB ⇋ cC + dD
Trong đó A, B, C, D là những chất khí hay những chất tan trong một dung dịch. Khi phản ứng ở trạng thái cân bằng ta có:
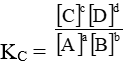
KC là hằng số cân bằng nồng độ của phản ứng chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ các chất ban đầu.
Chú ý: Giá trị của hằng số KC phụ thuộc vào cách viết phương trình phản ứng hóa học.
2. Cân bằng trong hệ dị thể
Hệ dị thể là hệ là hệ có bề mặt phân chia trong hệ, qua bề mặt này có sự thay đổi đột ngột tính chất.
Ví dụ: hệ gồm chất rắn và chất khí, hệ gồm chất rắn và chất tan trong dung dịch.
Xét hệ cân bằng: C + CO2 ⇋ 2CO.
Hằng số cân bằng:
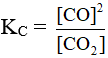
Nồng độ chất rắn coi là hằng số, nên trong biểu thức tính KC không tính chất rắn.
III. Sự chuyển dịch cân bằng hóa học
- Sự chuyển dịch cân bằng hóa học là sự chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
IV. Các yếu tố ảnh hưởng đến cân bằng hóa học
1. Ảnh hưởng của nồng độ
- Khi tăng hoặc giảm nồng độ của một chất trong cân bằng thì cân bằng chuyển dịch theo chiểu làm giảm tác dụng của việc tăng hoặc giảm nồng độ của chất đó.
Lưu ý: Đối với hệ cân bằng có chất rắn thì việc thêm hay bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
2. Ảnh hưởng của áp suất
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
Lưu ý: Khi hệ cân bằng có số mol khí ở 2 về bằng nhau hoặc trong hệ không có chất khí thì việc tăng, giảm áp suất chung của hệ không làm cho cân bằng chuyển dịch.
3. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ thì cân bằng chuyền dịch theo chiều phản ứng thu nhiệt, nghĩa là làm giảm tác dụng của việc tăng nhiệt độ. Còn khi giảm nhiệt độ thì cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, nghĩa là làm giảm tác dụng của việc giảm nhiệt độ.
- Nguyên lí chuyển dịch cân bằng (Nguyên lí Lơ Sa-tơ-li-ê): "Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp-suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác động bên ngoài đó”.
4. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng vì không làm thay đổi nồng độ, áp suất và hằng số cân bằng.
- Nhưng chất xúc tác làm tăng tốc độ phản ứng cả thuận và nghịch nên hệ nhanh chóng đạt đến cân bằng.
V. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
- Trong công nghiệp và sản xuất việc tăng tốc độ phản ứng và chuyển dịch cân bằng giúp phản ứng thực hiện nhanh và đạt hiệu suất cao.

